外源精子基因组整入雌核生殖银鲫卵子创制异源八倍体的有效方法

外源精子基因组整入雌核生殖银鲫卵子创制异源八倍体的有效方法
李 志 鲁 蒙 周 莉 王忠卫 李熙银 汪 洋 张晓娟 桂建芳
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072;2. 中国科学院种子创新研究院, 北京 100101; 3. 中国科学院大学, 北京 100049)
多倍化(Polyploidy)是指基因组中加入了一套或多套完整的基因组, 从而产生含有3套或3套以上完整染色体组的生物体即多倍体(Polyploid)的过程。同源或异源多倍体可通过发育早期有丝分裂受到抑制导致染色体组加倍, 减数分裂异常产生不减数配子、多精受精或杂交等产生[1—3]。尽管基因组加倍后可能对多倍体造成细胞核质比例失衡、有丝分裂和减数分裂同源染色体配对紊乱、表观遗传不稳定等不利影响, 但多倍体通常表现出杂种优势、基因冗余和单性繁殖三个优势[1]。大量冗余的重复基因为基因功能的歧化提供了原始材料;“多倍化-二倍化”过程中发生了大量染色体重排、转座子重激活、表观遗传重塑等其他非孟德尔的基因组变化[4—9], 使得多倍体产生新的性状并驱动改变生态位和扩大地理分布[1,10—12]。因此, 基因组多倍化是物种演化的主要驱动力之一[1,3,13—18]。
从理论上说, 由于基因组倍性的增加, 往往细胞尺寸会随之增加, 多倍体常常表现出比二倍体近亲生长更快, 营养器官或个体更大[19]等特点; 也常常表现出适应性和抗病力强等优良经济性状[2,3,20]。基于这一原因, 大量天然的多倍体鱼类, 如鲤、银鲫、鲫、鲑和鲟等, 已被选为重要的水产养殖对象[3]。银鲫曾被视为鲫(Carassius auratusL.)的一个亚种(C. auratus gibelioBloch)[21], 但随着对其核型、生殖方式、性别决定方式等研究的深入, 已被视为一个独立的物种(C. gibelio), 并被证实经历了连续的额外两轮多倍化, 因而被称为六倍体[22—26]。银鲫的卵子可以被异源的精子刺激激活胚胎发育, 采用单性雌核生殖的方式繁衍后代[3,20]。有趣的是, 当进行异精雌核生殖时, 银鲫具有将其他鱼类精子的染色体组、染色体片段并入到卵核中协同发育的能力[21,27—29]。这种独特的能力可为异育银鲫新品种选育创制优异种质[30], 并有望从中选育出生长快、抗病力强的新品种。譬如, 异育银鲫“中科5号”[20,31—33]和“长丰鲫”[34]的选育就是利用了这种能力。
通过异精雌核生殖自发形成异源八倍体子代的概率仅为0.2%—0.33%[29,35]。由于异源的精子进入银鲫卵质后, 不解凝, 呈固缩状态[36,37], 因此丁军等[35]尝试用胰蛋白酶处理红鲤精子后再与银鲫卵子受精, 根据其细胞学观察结果推测胚胎中的异源八倍体率可提高到3.3%。尽管他们未能获得异源八倍体幼鱼, 但他们的尝试为建立一个简单易行的、可用于创制渗入有异源精子整套染色体组或部分染色体的银鲫新种质的方法提供了雏形。白鲫(C. cuvieri)具有食性广、生长快、体型大、适应性强等优势[38], 且与银鲫具有相似的外形。因此,在本研究中, 我们摸索了胰蛋白酶消化浓度和时间等处理异源白鲫精子的条件, 通过分析对照组与不同处理组合中受精率、孵化率、成活率、畸形率、一月龄子代中八倍体率的差异, 以及精子活力和精子结构的变化, 建立了一种将外源精子基因组整入雌核生殖银鲫卵子创制异源八倍体的有效方法; 并运用该方法批量处理并结合流式细胞术筛选6月龄子代, 获得57尾融入有白鲫精子染色体组的异源八倍体。该方法的建立为后续培育生长快、抗病能力强的银鲫新品种提供了技术支撑, 创制的异源八倍体可作为新品种培育的核心育种材料。
1 材料与方法
1.1 实验材料和溶液
异育银鲫“中科3号”(A+系)来自中国科学院水生生物研究所官桥养殖基地(武汉), 白鲫取自广西水产引育种中心(南宁)。在繁殖季节, 选择性成熟亲鱼, 注射鲤脑垂体(PG)、绒毛膜促性腺激素(HCG)和促黄体素释放激素类似物(LHRH-A2)的混合物人工催产获得成熟的卵子和精子[39]。
1×精子保存液(8 g/L NaCl, 0.4 g/L KCl, 0.14 g/L CaCl2, 0.2 g/L MgSO4·7H2O, 0.06 g/L Na2HPO4·H2O,0.06 g/L KH2PO4, 0.35 g/L NaHCO3, 1 g/L葡萄糖),用灭菌H2O配置, pH调制6.9。
1.2 精液的胰蛋白酶溶液处理及人工受精
首先将0.25、0.5、1、2和4 g胰蛋白酶粉末分别加入到100 mL的1×精子保存液中, 新鲜配置成0.25%、0.5%、1%、2%和4%的胰蛋白酶溶液。对照为未加入胰蛋白酶的1×精子保存液。每次按1﹕10体积比将精液与不同浓度的胰蛋白酶溶液(实验组)或1×精子保存液(对照组)混匀, 并在23℃静置10min后, 分别与异育银鲫A+系的成熟卵子进行干法授精[39]。将受精卵分别铺洒在装有曝气水的白瓷盘(每盘铺洒约2000—4000个受精卵)中进行孵化。每组实验进行三次重复。统计不同组合的受精率、畸形率、存活率以及八倍体率。
接着, 按1﹕10体积比将精液与1%的胰蛋白酶溶液(实验组)或1×精子保存液(对照组)混匀, 23℃静置处理5min、10min、15min、20min和25min后,采用相同方法进行受精和孵化。
1.3 精子的活力检测及扫描电镜(Transmission electron microscope, TEM)观察
精子的活力在HT CASAⅡAnimal系统中测定,统计精子被激活1min之内的运动参数, 参照朱要军等[40]描述方法进行。在23℃, 水激活精子后, 每隔3s点击软件“俘获”键, 持续捕捉精子运动参数, 每次样品至少进行7次平行测量。
精子形态观察是在中国科学院水生生物研究所仪器平台中心的HT7700透射电镜(Hitachi High-Tech)上进行, 样品的制备方法参照朱要军等[40]。
1.4 繁育亲本及子代的倍性检测和染色体核型分析
每个实验组合随机选取25—124尾一月龄幼鱼(体长1.5 cm左右), 断尾采约0.1 μL的新鲜血液放入200 μL 4℃预冷的CyStain DNA 1Step(德国Partec CyStain DNA 1Step)溶液并混匀后放置冰上, 等待上机检测DNA含量(CytoFLEX流式细胞仪)。其中1%的胰蛋白酶溶液处理15min的子代, 养至六月龄时检测倍性, 共检测340尾个体的DNA含量。亲本异育银鲫A+系和白鲫作为对照。
采用PHA体内诱导肾细胞制片技术, 制备繁育亲本及子代的中期分裂相, 具体方法参照[41, 42]。
1.5 数据统计分析
受精率、孵化率、成活率、畸形率、八倍体率分别根据如下公式进行统计[42,43]:
受精率(Fertilization rate,FR, %)=(受精卵数/总卵数)×100%
孵化率(Hatching rate,HR, %)=(总出苗数/总卵数)×100%
成活率(Survival rate,SR, %)=(开始摄食时正常鱼苗数/总卵数)×100%
畸形率(Deformity rate,DR, %)=(畸形鱼苗数/总出苗数)×100%
八倍体率(Octoploid rate,OR, %)=(八倍体鱼苗数/所检测的总鱼苗数)×100%
将上述数据用SPSS软件进行差异显著性分析,独立重复的实验数据用“平均值±标准差”表示。采用SPSS软件进行单因素方差分析, 数据间比较用Duncan法进行。柱状图由GraphPad Prism 6软件绘制,P<0.05视为统计学显著性差异,P<0.01视为统计学极显著性差异。
2 结果
2.1 不同浓度胰蛋白酶溶液处理白鲫精子对异育银鲫子代八倍体率的影响
首先进行胰蛋白酶浓度梯度分析以确定本实验的最适处理浓度。我们选择了0.25%、0.5%、1%、2%和4%共5种浓度的胰蛋白酶溶液, 同时处理白鲫精液10min后与异育银鲫A+系的成熟卵子受精。与对照组相比, 胰蛋白溶液处理白鲫精子会导致受精率、孵化率和存活率均显著下降(表1)。将每个组合孵化的正常鱼苗养至1月龄, 随机挑选个体进行流式细胞术测定DNA含量。结果表明, 在对照组的25尾幼鱼中, 未能检测到八倍体个体, 均为六倍体个体(图1A)。在0.25%胰蛋白酶溶液处理白鲫精子10min后的子代, 可以检测到八倍体个体, 其DNA直方图的峰值与六倍体个体峰值比例为4﹕3(图1A-B)。随着胰蛋白酶浓度的增加, 子代平均八倍体率从(3.8±0.6)%显著上升到(18.5±1.4)%(表1)。2%和4%胰蛋白酶溶液处理的鱼苗平均畸形率分别为(15.3±1.8)%和(33.2±8.8)%, 显著高于其他3个浓度处理组合; 1%胰蛋白酶溶液处理的子代平均八倍体率可达(8.3±2.4)%, 显著高于0.25%和0.5%处理组合, 而其平均畸形率与对照组和两个低浓度组合无显著差异。
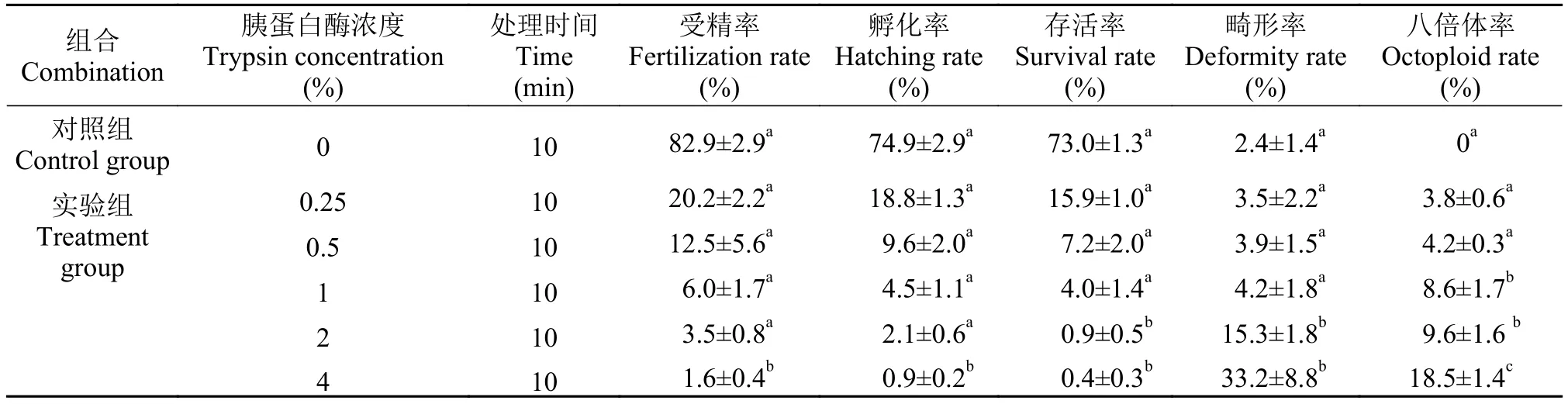
表1 不同浓度胰蛋白酶溶液处理白鲫精子对异育银鲫A+系受精卵孵化、仔鱼成活以及子代八倍体率的影响Tab. 1 Effects of C. cuvieri sperm digested with trypsin solution at different concentrations on the hatching, survival and octoploid rates of allogynogenetic gibel carp clone A+
2.2 不同浓度胰蛋白酶溶液处理后白鲫精子的运动活力和结构变化
从不同运动类型精子的比例、激活或前进性精子运动速度和方式以及鞭毛鞭打频率四个方面对不同组合白鲫精子的活力进行了比较。从精子运动比例来看, 激活精子(MOT)和前进性运动精子(PRO)比例均随着胰蛋白酶浓度的增加而下降, 而慢速运动精子(SLO)比例呈现上升趋势。与对照组相比, MOT下降幅度表现出显著性差异的是4%的胰蛋白酶浓度处理, PRO下降幅度和SLO上升幅度表现出显著性差异的是2%和4%的胰蛋白酶浓度处理(图1C)。激活精子运动速度检测结果表明,2%和4%胰蛋白酶处理白鲫精子10min后, 激活精子的平均路径速度(VAP)、直线运动速度(VSL)和曲线运动速度(VCL)均急剧下降。激活精子运动方式的变化不明显, 与对照组相比, 仅当用4%胰蛋白酶处理时摆动性(WOB)呈现显著性下降(图1D)。不同浓度的胰蛋白酶溶液处理10min对白鲫前进性精子的运动速度、方式和鞭毛鞭打频率影响较小, 仅当用4%胰蛋白酶处理时, 前进性精子的VSL和WOB显著性下降(图1E)。
我们也采用透射电镜观察了不同浓度胰蛋白酶溶液处理对白鲫精子质膜结构的影响。精子头部横切面透射电镜观察(图1F)结果表明, 未经胰蛋白酶处理的白鲫精子头部质膜呈双线形结构, 与核结合较紧密。当用0.25%的胰蛋白酶溶液处理10min后,精子质膜与核之间的空隙增多, 质膜少数地方出现破损断裂。随着胰蛋白酶浓度的增加, 质膜呈现明显的波浪状皱褶, 质膜与核膜之间的空隙越来越大,质膜被酶解破损程度加剧, 部分质膜脱落。从1%的胰蛋白溶液处理组合开始, 可以观察到核膜不完整,部分被酶解。因此, 综合考虑子代八倍体率、畸形率、存活率以及精子活力和结构等因素, 我们选定1%的胰蛋白酶浓度为有效处理浓度。
2.3 1%胰蛋白酶溶液处理白鲫精子不同时间后对异育银鲫子代八倍体率的影响
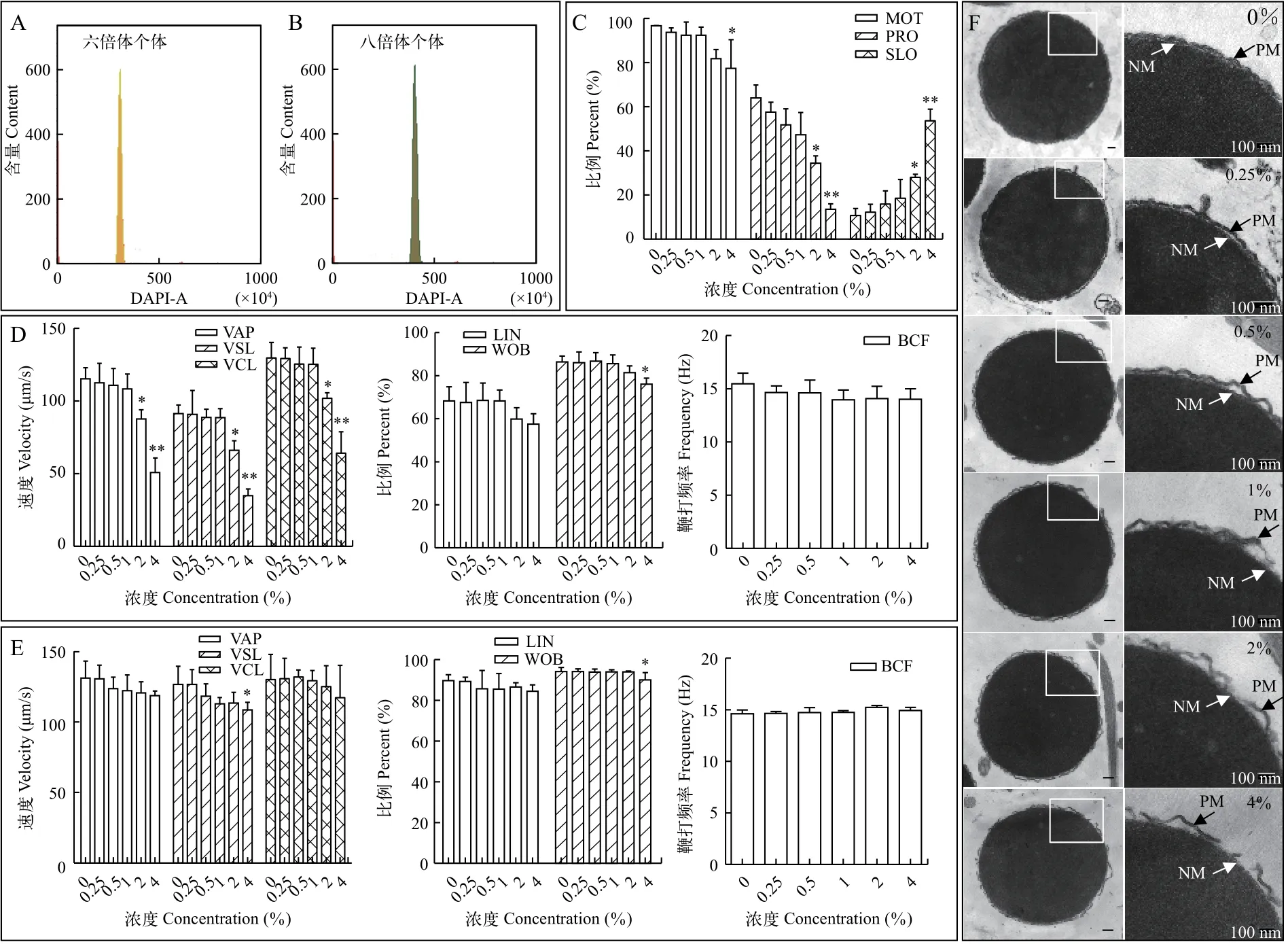
图1 不同浓度胰蛋白酶溶液处理对子代倍性(A-B)、精子运动能力(C-E)和精子结构(F)的影响Fig. 1 Effects of C. cuvieri sperm digested with trypsin solution at different concentrations on offspring ploidy (A-B), sperm motility (C-E)and structure (F)
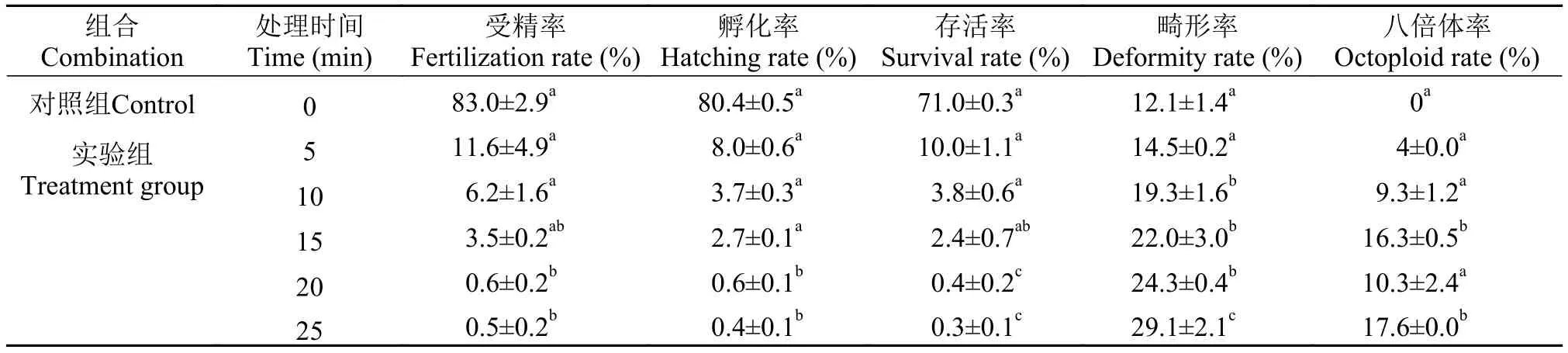
表2 1%胰蛋白酶溶液处理白鲫精子不同时间对异育银鲫A+系受精卵孵化、仔鱼成活以及子代八倍体率的影响Tab. 2 Effects of C. cuvieri sperm digested with 1% trypsin solution at different times on the hatching, survival and octoploid rates of allogynogenetic gibel carp clone A+
用1%的胰蛋白酶溶液分别处理白鲫5min、10min、15min、20min和25min后, 分别与异育银鲫A+系的成熟卵子受精(表2)。与对照组相比, 1%胰蛋白酶溶液处理5min后, 子代中的平均八倍体率为(4±0.0)% (图2A-B), 但受精率、孵化率和存活率均显著下降, 仅有10%左右。随着处理时间的增加,如处理15min后, 子代中的平均八倍体率上升至(16.3±0.5)%, 而受精率、孵化率和存活率进一步呈梯度下降。1%胰蛋白酶溶液处理25min后, 受精率、孵化率和存活率降到千分之几, 同时畸形率显著上升, 而子代八倍体率与处理15min组合没有显著差异。
2.4 1%的胰蛋白酶溶液处理不同时间后白鲫精子运动活力和结构变化
与对照组相比, 1%胰蛋白酶溶液处理不同时间, 对MOT、PRO和SLO的比例没有显著影响。仅当处理25min时, SLO上升比例与对照组比有显著差异(图2C)。精子运动速度检测结果表明, 处理20min和25min后, 激活精子的VAP和VCL显著下降(图2D); 处理25min后, 精活精子的WOB、前进性精子的VSL和VCL, 与对照组比显著下降(图2D-E)。
同样, 我们采用透射电镜观察1%胰蛋白酶溶液处理白鲫精子不同时间后的结构变化(图2F)。与对照组相比, 处理5min后, 精子质膜与核之间的空隙明显增多增大; 处理10min后, 质膜呈现明显的波浪状皱褶, 核膜的少数部分出现酶解损坏; 处理15min后, 质膜与核膜之间的空隙进一步加大, 质膜开始酶解脱落。处理20min和25min后的精子头部结构与处理15min的没有明显差异。

图2 1%胰蛋白酶浓度处理不同时间对子代倍性(A-B)、精子运动能力(C-E)和结构的影响Fig. 2 Effects of C. cuvieri sperm digested with 1% trypsin solution at different times on offspring ploidy (A-B), sperm motility (C-E) and structure (F)
2.5 银鲫新八倍体的创制及其DNA含量和染色体核型分析
综合考虑子代八倍体率、畸形率、存活率以及精子的运动活力等因素, 我们选定1%的胰蛋白酶浓度处理15min作为有效处理条件, 大规模创制合成银鲫新多倍体。将获得的正常鱼苗养至6月龄时, 进行流式细胞术检测DNA含量筛选银鲫新多倍体。在分析的340尾个体中, 共有57尾个体被鉴定为八倍体, 体型与母本异育银鲫A+系虽相似, 但略有差异(图3A); 其DNA直方图的峰值与母本、父本的比值分别为4﹕3﹕2 (图3B); 肾细胞有丝分裂中期染色体计数分析表明, 八倍体个体的染色体数目为209±6, 母本异育银鲫A+系的染色体数为159±6,父本白鲫的染色体数为100(图3C)。上述的结果表明, 创制的银鲫异源八倍体是A+系卵子融入了一套白鲫精子染色体组发育而来。

图3 银鲫异源八倍体与亲本的形态(A)、DNA含量(B)和染色体数量(C)差异Fig. 3 Differences of morphology (A), DNA content (B) and chromosome number (C) among gibel carp allo-octoploid and its parents
3 讨论
作为一种经典、且卓有成效的细胞工程育种技术, 多倍体育种(Polyploid breeding)已广泛地运用于动植物育种中, 包括在养殖鱼类和贝类的品种选育中[2,3,20,44,45]。在水产养殖动物中, 成功的范例有三倍体太平洋牡蛎[46,47]以及从鲤科和鲑科等天然多倍体鱼类中合成的同源或异源多倍体[3,43]。因此, 依据物种特性, 优化或发展新的、高效的倍性操作技术, 一直是水产养殖动物遗传育种的重要方向之一。
异育银鲫是我国重要的大宗淡水养殖鱼类之一[20], 是由银鲫培育出来的系列品系的统称。银鲫雌核生殖和异精效应[48], 有性生殖和雄性个体在种群作用[21]等的揭示, 为异育银鲫新品种的培育开创了一条独特的育种技术路线。在过去的四十多年里, 异育银鲫[49]、高体型异育银鲫[20]、异育银鲫“中科3号”[50]、“长丰鲫”[34]和异育银鲫“中科5号”[31—33]等系列新品种陆续被选育出来, 并带动我国鲫鱼养殖业的迅速发展[3,20,21]。其中, 异育银鲫“中科5号”是从渗入有团头鲂精子微小染色体片段、性状发生明显改变的育种核心群体, 经连续十代雌核生殖选育而来[20,31—33]; “长丰鲫”是D系银鲫卵子融入了一套兴国红鲤精子的染色体组发育而来[34], 且遗传和表观遗传稳定, 仍保持着雌核生殖的能力[4]; 在A+系银鲫用兴国红鲤精子刺激发育的子代中也发现了类似的异源八倍体个体[41]。在本研究中, 我们通过设置不同的胰蛋白酶消化异源精子的浓度梯度和时间梯度, 优化并建立了一种将外源精子基因组整入雌核生殖银鲫卵子创制异源八倍体的有效方法。
用计算机辅助精子自动分析(Computer-aided sperm analysis, CASA)[50]已广泛运用于鱼类精子的活力检测中[40,51—53]。在硬骨鱼类中, 如非洲鲶、鲤、金鱼等精子运动参数与受精率的关联分析表明, 前进性运动精子的VCL和VSL是最能反映精子活力的参数, 在一定范围内与精子受精率呈正相关[54—58]。在本研究中, 用低浓度胰蛋白酶溶液处理白鲫精子, 或者高浓度胰蛋白酶溶液处理较短时间,对精子的运动能力没有影响。在光学显微镜下对不同组合精子运动能力的观察结果(未显示)与CASA一致。但0.25%的胰蛋白酶溶液处理白鲫精子10min以及1%胰蛋白酶溶液处理白鲫精子5min后, 均导致受精率显著下降至10%—20%左右(表1和表2)。因此, 异育银鲫受精率显著下降与白鲫精子的运动能力之间没有明显关联。正常受精时, 硬骨鱼类的精子穿过精孔管, 精子质膜与卵子质膜发生相互识别和融合, 精核入卵, 随后发生精核核膜崩解等一系列复杂的生理变化。考虑到精子质膜的完整性与其受精能力呈高度正相关[59], 我们也采用透射电镜观察了白鲫精子结构在胰蛋白酶溶液处理后的变化。胰蛋白酶消化处理白鲫精子, 必然导致精子结构受损。0.25%的胰蛋白酶溶液处理白鲫精子10min以及1%胰蛋白酶溶液处理白鲫精子5min后, 均观察到精子质膜与核之间的空隙明显增多增大; 随着胰蛋白酶浓度的增加, 质膜被酶解破损程度加剧, 部分质膜脱落(图1F和图2F)。上述的结果表明, 精子质膜上与精卵识别相关的蛋白, 以及其他质膜结构受损应该是异育银鲫受精率显著下降的主要原因。
细胞学观察表明, 进入银鲫受精卵的异源精核不解凝, 高度固缩, 不与雌性原核融合, 为典型的雌核生殖生殖方式; 而进入银鲫受精卵的同源精核可部分解凝[49]。两性生殖物种非细胞体系中的研究表明, 脱膜精核在卵质提取物中的解凝不具有物种特异性[60—62]。譬如, 我们不仅可以观察到银鲫脱膜精核在银鲫卵质提取物, 兴国红鲤脱膜精核在兴国红鲤提取物中解凝, 也可观察到银鲫脱膜精核在兴国红鲤卵质提取物中发生疏松、解凝等形态变化。但将兴国红鲤脱膜精核在银鲫卵质提取物中进行温育, 未能观察到精核的解凝[63]。这些在体和离体的观察均表明, 银鲫的卵质中可能存在着抑制异源精核解凝的调控因子; 同时异源和同源精核在银鲫卵质中所呈现的截然不同的发育行为也暗示精核解凝与精子的成分相关。如果保持核膜的完整性, 无论是银鲫还是红鲤精核, 在银鲫或红鲤卵质提取物中均不能解凝[63], 暗示精子核膜的崩解是非细胞体系精核解凝的前提条件。我们的结果表明, 1%浓度以上的胰蛋白溶液处理白鲫精子10min以上, 可以观察到核膜不完整, 部分被酶解(图1F和图2F)。因此, 我们猜测核膜的部分消解可能会导致精核的遗传物质渗入受精卵卵质中, 从而大幅提高了子代中的八倍体率。因此, 综合考虑子代八倍体率、畸形率、存活率, 以及CASA分析精子活力和透射电镜观察精子结构变化结果, 我们选择1%的胰蛋白酶浓度处理15min作为有效处理条件, 大规模创制合成银鲫新多倍体。
总之, 本研究建立了一种将外源精子基因组整入雌核生殖银鲫卵子创制异源八倍体的有效方法,兼顾受精率、孵化率、成活率等繁育指标与较高的子代八倍体率, 以期在异育银鲫育种实践中获得较多子代同时减少筛选工作量。在本研究中筛选获得的57尾融入有白鲫精子染色体组的异源八倍体成鱼, 可作为后续培育生长快、抗病能力强的银鲫新品种的核心育种材料。
声明:本站未注明出处的转载文章是出于传递更多信息之目的。若有未注明出处或标注错误或侵犯了您的合法权益,请与本网站联系,我们将及时更正、删除,谢谢!


欢迎关注本站"养鱼第一线"微信公众帐号和头条号!将会定期向你推送本号信息!将为你精诚服务!


