论文:饲料中胆汁酸添加水平对牛蛙肝脏化学组成、抗氧化和代谢酶活力的影响
饲料中胆汁酸添加水平对牛蛙肝脏化学组成、抗氧化和代谢酶活力的影响
胡田恩1,王玲1,张春晓1,宋凯1,曲玲1,李金宝2
(1.集美大学水产学院,厦门市饲料检测与安全评价重点试验室,福建厦门361021;
2.山东龙昌动物保健品有限公司,济南250062)
摘要:试验将144只(初始质量75.01 g±4.23 g)牛蛙(Ranacatesbeiana)随机分在12个玻璃水族缸中,每组3个重复,每个重复12只牛蛙。分别向每千克基础饲料中添加0、100、200和300 mg胆汁酸,配制成4种等氮等能的试验饲料。试验期8周。结果表明:1)饲料中添加100 mg/kg的胆汁酸显著降低肝脏粗脂肪含量,升高水分含量。2)随着胆汁酸添加量的增加,超氧化物歧化酶(SOD)呈先升高后降低的趋势,添加量为200 mg/kg时最高;添加胆汁酸显著提高了谷胱甘肽过氧化物酶(GSH-Px)活力;添加200 mg/kg的胆汁酸显著降低了丙二醛(MDA)含量,当添加量为300 mg/kg,MDA显著升高。3)肝脏谷草转氨酶随着胆汁酸含量的升高呈先升高后降低趋势,其中添加量200 mg/kg时最高,各添加水平对谷丙转氨酶活力无显著影响;添加100和200 mg/kg胆汁酸显著降低肝酯酶(HL)和脂蛋白酯酶(LPL)活力。4)饲料中添加300 mg/kg的胆汁酸组牛蛙肝脏颜色呈紫黑色,有白斑,肝脏质地硬。综上,饲料中添加适量的胆汁酸能通过调节牛蛙肝脏脂类代谢水平和抗氧化能力以维持肝细胞的正常功能,建议胆汁酸添加量以不超过200 mg/kg为宜。
关键词:牛蛙(Ranacatesbeiana);胆汁酸;肝脏;抗氧化
近年来,随着我国高密度、集约化水产养殖模式的快速发展,越来越多的养殖动物出现肝脏脂肪大量积累的现象,肝脏是动物最重要的代谢器官之一,其损伤或病变极易造成动物营养代谢失调,免疫系统紊乱。患有脂肪肝的水生动物通常表现为应激能力低下,死亡率高,饲料利用率低。而蛋白/能量比不合理,日粮中维生素、必需脂肪酸和胆碱等含量不足,一般被认为是诱导水生动物肝脏脂肪过度沉积的主要原因[1-3]。牛蛙(Ranacatesbeiana)具有生长快、肉质鲜美、营养丰富等特点,其养殖产量逐年增加,2013年达到15万吨以上,养殖区域主要分布在福建、广东、浙江等沿海地区[4]。目前国内外对牛蛙营养的研究还仍处于起步阶段,已有的研究仅限于牛蛙对饲料蛋白和脂肪需要量方面的相关报道,Seixas-Filho等[8]发现养殖过程中牛蛙极易发生肝脏疾病,而高密度养殖、高频率投喂的养殖方式以及营养不均衡的饲料、不稳定的环境条件等诸多因素常引起养殖牛蛙肝脏病变,并可能进一步诱导其他疾病的发生,所以,急需寻求一种有效的降脂护肝方法,以维护牛蛙肝脏健康,促进牛蛙养殖业的可持续发展。
胆汁酸为双亲性分子,其环戊烷多氢菲核α侧的羟基(-OH)、羧基(-COOH)、磺酰基(-SO3H)是亲水性基团,β侧的甲基 (-CH3)、烃核是疏水性基团,这种构型使得胆汁酸具有亲水和疏水的性质。Poupon等[9]用反相高效色谱测定胆汁酸滞留时间的方法表明,胆酸(CA)、脱氧胆酸(DCA)、鹅去氧胆酸(CDCA)和石胆酸(LCA)均为疏水性胆汁酸,比较而言,猪胆酸和猪去氧胆酸是相对亲水的胆汁酸,已有报道猪去氧胆酸在降脂、保护肝脏方面具有重要作用[10,11],CDCA对改善与肠外营养有关的肝脏疾病有重要作用[12]。然而,也有研究认为CDCA有毒性,可以诱导细胞凋亡,甚至产生癌变[13,14]。目前,已证实胆汁酸的细胞毒性作用与其疏水性和剂量呈正相关[9,15]。而商业的胆汁酸通常是亲水性胆汁酸和疏水性胆汁酸的混合物,本试验以牛蛙为研究对象,旨在研究饲料中添加不同剂量的胆汁酸对牛蛙的肝脏化学组成、抗氧化能力和代谢酶活力的影响,初步探索胆汁酸对牛蛙肝脏生理的影响机制,以期为牛蛙饲料中胆汁酸的合理应用提供参考。
1材料与方法
1.1试验饲料配方
基础饲料粗蛋白约41%,粗脂肪约7%,以鱼粉和豆粕为主要蛋白源,棕榈油为主要脂肪源,面粉为主要糖源,外加多种维生素和多种矿物质等配制而成。胆汁酸纯度99.1%,其中猪胆酸和猪去氧胆酸总和78.9%,鹅去氧胆酸20.2%,由山东龙昌动物保健品有限公司提供。分别向每千克基础饲料中添加0、100、200和300 mg胆汁酸配制出4种等氮等能的试验饲料(表1)。原料经粉碎机粉碎后,过60目筛,各原料按比例逐级混匀后加油揉匀,再加适量的去离子水进一步搓匀,经水产饲料膨化机制成直径为4.0 mm 的膨化颗粒饲料,自然阴干后密封储存在-20 ℃的冰箱中备用。
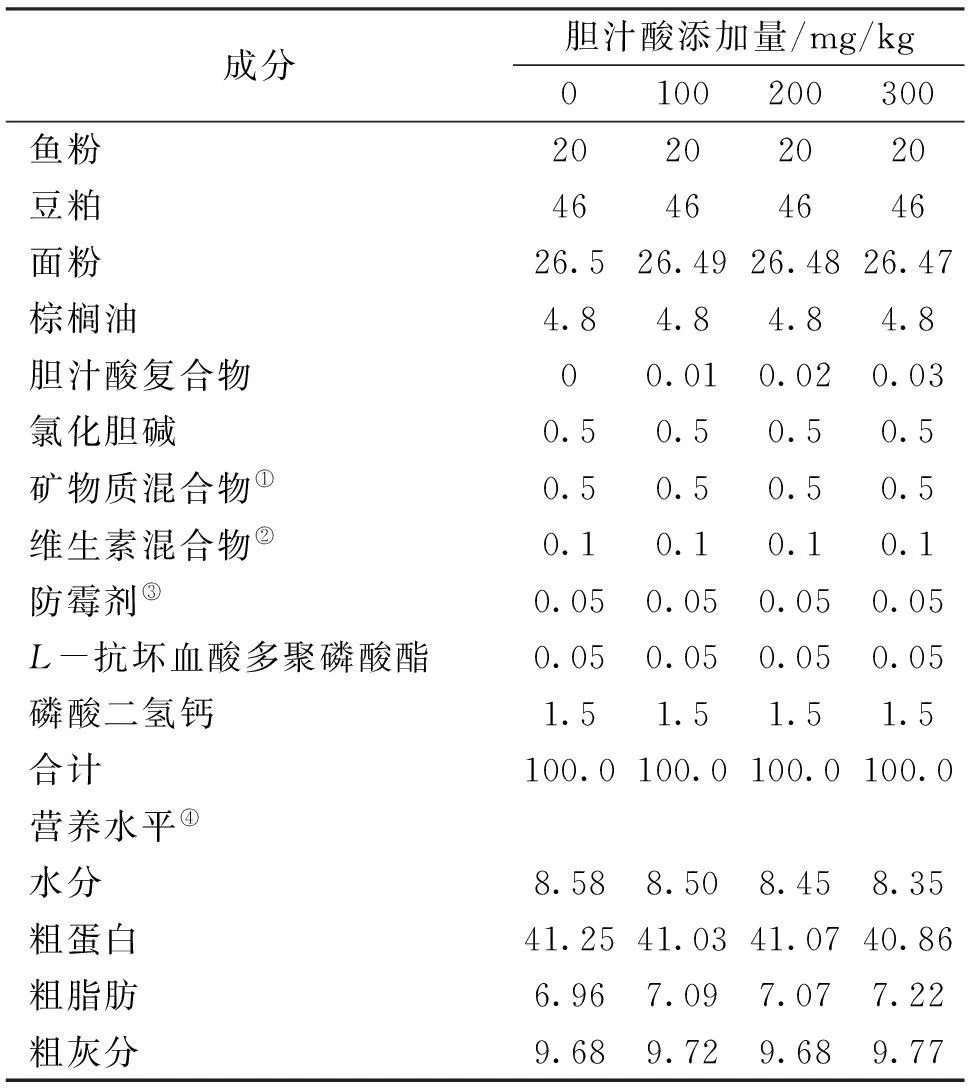
表1 饲料组成与营养成分
注:①矿物质混合物( mg/kg饲料):氯化钾,200;碘化钾,60;硫酸钴,100;硫酸铜,24;硫酸亚铁,400;硫酸锌,174;硫酸锰,78;硫酸镁,800;亚硒酸钠,50;沸石粉,3114。
②维生素混合物( mg/kg饲料): 维生素B1,10;核黄素,8;盐酸吡哆醇,10;维生素B12,0.2;维生素K3,10;肌醇,100;泛酸钙,20;烟酸,50;叶酸,2;生物素,2;维生素A(50万IU),400;维生素D3,5;维生素E(50万IU),100;乙氧基喹啉,150;次粉,1135.③50%丙酸钙和50%富马酸。④营养水平为实测值。
1.2试验牛蛙与饲养管理
试验牛蛙购自厦门市同安区某养殖场的同一批孵化的牛蛙,经食盐消毒,暂养于生态实验室水族箱中,以试验基础饲料饱食投喂,使之逐渐适应试验饲料及养殖环境。暂养15 d后,将牛蛙饥饿24 h,挑选体格健壮、大小均匀,初始体重(75.01±4.23)g的牛蛙144只,随机分到12个底面积0.25 m2水族箱中(长×宽×高=68 cm×38 cm×36 cm),然后将12个水族箱随机分为4个处理,每个处理3个重复。维持缸内水面高度在4 cm左右,每天按1.5%饱食投喂2次(8∶00,18∶00),投喂前30 min对各缸清洗、换水。养殖期间温度为(28±2) ℃,光照14 h/d,每天记录牛蛙的摄食和死亡情况。养殖试验持续8周。
1.3样品采集及分析测定方法
养殖试验结束后,将牛蛙禁食24 h,分别从每缸中随机抽取3只牛蛙,用双毁髓法处死,迅速解剖取肝脏,观察肝脏外部形态并记录,将3只牛蛙的肝脏合在一起,然后将其置于-80 ℃冰箱,用于测肝脏抗氧化酶、代谢酶活力和组织化学成分。
粗酶液制备 取1.0 g肝脏加入9 mL,浓度为0.7%的4 ℃的生理盐水,10000 r/min冰浴匀浆,匀浆液于高速冷冻离心机3000 r/min离心10 min,取上清液制得粗酶液。用于测定肝脏中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)等抗氧化酶活力和谷草转氨酶(GOT)、谷丙转氨酶(GPT)、脂蛋白酯酶(LPL)、肝酯酶(HL)等代谢酶活力。其中SOD活力采用羟胺法,CAT活力采用钼酸铵法,GSH-Px活力采用二硫代二硝基苯甲酸比色法,MDA含量采用硫代巴比妥酸(TBA)法测定,GOT和GPT活力采用赖氏法测定。肝酯酶、脂蛋白酯酶活力采用比色法测定,活力单位定义为每毫克组织蛋白每小时在反应系统中所产生的1微摩尔(μmol)的游离脂肪酸FFA为1个酶活力单位[FFA μmol/(mg prot·h)]。以上各指标均采用南京生物工程研究所提供的试剂盒测定,具体操作参见说明书。
饲料和肝脏中水分、粗蛋白、粗脂肪和粗灰分的含量参照AOAC[16]的方法测定。粗蛋白采用凯氏定氮法(N×6.25),用FOSS公司生产的Kjeltec8400型全自动凯氏定氮仪进行测定;粗脂肪采用索氏抽提法;粗灰分采用马福炉550 ℃灼烧法;水分采用105 ℃恒重法。
1.4数据统计
试验数据结果经Excel 2007初步整理后,采用SPSS19.0软件进行单因素方差分析(One-way ANOVA),若差异显著,则采用Duncan氏法进行多重比较,差异显著水平为P<0.05。试验结果均采用平均值±标准误(x±SE)表示。
2结果
2.1饲料中添加胆汁酸对牛蛙肝脏化学成分的影响
由表2可知,饲料中添加100 mg/kg胆汁酸时,肝脏粗脂肪含量较对照组显著降低,当胆汁酸添加量为200和300 mg/kg时,脂肪含量与对照组无显著差异,而肝脏水分与脂肪变化趋势相反。饲料中添加胆汁酸对肝脏中粗蛋白和粗灰分含量均无显著性影响。

表2 饲料中添加胆汁酸对牛蛙肝脏化学成分的影响(n=3)
注:同行上标小写字母不同代表差异显著(P<0.05),以下各表相同。
2.2饲料中添加胆汁酸对牛蛙肝脏抗氧化酶活力和MDA含量的影响
饲料中添加胆汁酸显著提高了肝脏谷胱甘肽过氧化物酶(GSH-Px)活力。当胆汁酸添加量为200 mg/kg时,SOD活力显著高于其他组。丙二醛(MDA)含量呈先降低后升高的趋势,其中当添加量为200 mg/kg时最低,而300 mg/kg时MDA含量显著升高。各试验组间肝脏CAT活力无显著差异(表3)。

表3 饲料中添加胆汁酸对肝脏抗氧化指标的影响(n=3)
2.3饲料中添加胆汁酸对牛蛙肝脏代谢酶的影响
由表4可知,随着胆汁酸添加量的增加,谷草转氨酶活力呈先升高后下降的趋势,当添加100 mg/kg时谷草转氨酶活力最高,各组之间谷丙转氨酶活力无显著性差异。饲料中添加胆汁酸显著影响了酯酶的活力,当胆汁酸添加量为100和200 mg/kg时,肝酯酶和脂蛋白酯酶活力较对照组均显著降低。

表4 饲料中添加胆汁酸对牛蛙肝脏谷草转氨酶、谷丙转氨酶、脂蛋白酯酶和肝酯酶活力的影响(n=3)
2.4饲料添加胆汁酸对牛蛙肝脏外部形态的影响
牛蛙解剖后发现肠系膜少量脂肪蓄积,肝脏大小正常,不同处理组肝脏颜色各有差异。对照组肝脏颜色淡红,有油腻感,胆囊颜色茶褐色,有白点分布。100和200 mg/kg胆汁酸组牛蛙肝脏属于正常颜色;300 mg/kg组肝脏紫黑,并出现大面积的白斑,解剖后用手指轻轻按压离体肝脏,发现该组肝脏质地偏硬、无弹性。

表5 牛蛙肝脏组织病理变化特征
3讨论
3.1饲料中添加胆汁酸对牛蛙肝脏生化组成的影响
试验结果表明对照组肝脏脂肪含量为6.73%,而添加100 mg/kg胆汁酸组牛蛙肝脏脂肪含量迅速下降到4.96%,说明饲料中添加胆汁酸有助于减少肝脏脂肪沉积,降低脂肪肝的潜在风险。已有学者表明,饲料中添加适量的胆汁酸可以降低大菱鲆(Scophthalmusmaximus)[17]、军曹鱼(Rachycentroncanadum)[18]、草鱼(Ctenopharyngodonidellus)[19]肝脏脂肪含量。Gilat等[20]认为,饱和脂肪酸能在体内与胆酸结合形成脂肪酸-胆酸结合物(FABACs),FABACs可通过抑制羟基甲基戊二酸单酰辅酶A还原酶抑制胆固醇的合成,通过细胞色素P7A1酶介导的途径促进胆固醇向胆酸的转化,从而通过减少胆固醇含量来降低大鼠肝组织中脂肪含量。也有资料表明胆汁酸能通过激活G蛋白偶联胆汁酸受体(TGR5),刺激小鼠褐色脂肪组织分解供能[21],因此肝脏脂肪含量的降低也可能是胆汁酸作用下能量代谢增强的结果。也有学者报道[11],脱氧胆酸作为脂肪酸转运蛋白(FATP5)活力的一种抑制剂,而FATP5主要功能是促进长链游离脂肪酸(LCFA)向肝脏的转运,脱氧胆酸可以利用这种机制限制过多的LCFA的摄入,说明胆汁酸可通过减少脂肪酸的来源进而减少脂肪在肝脏的沉积。然而,疏水性胆汁酸具有细胞毒性,Song等[15]研究发现鹅脱氧胆酸对肝脏的毒性与剂量有关,当饲料中CDCA浓度为0~0.3 %时小鼠未表现出明显毒理症状,高于0.3%时毒性明显。本研究中,当胆汁酸添加量为200和300 mg/kg时,脂肪含量与对照组并无差异,但较100 mg/kg组显著升高,可能是其中的疏水性胆汁酸在一定程度上抑制线粒体的氧化磷酸化水平,降低胞内ATP合成速率[22],从而降低脂质的分解代谢。本试验结果说明饲料中添加胆汁酸对牛蛙肝脏脂肪含量的影响有明显的剂量效应,应当开展进一步研究确认牛蛙饲料中胆汁酸对其肝脏作用的具体机制。
3.3胆汁酸对牛蛙肝脏抗氧化能力影响
动物细胞生存需要适当的氧化与抗氧化平衡,当自由基产生量超过机体的抗氧化能力时,就会造成氧化损伤[23]。抗氧化酶在体内能构成一个重要的清除活性氧簇(ROS)的防御系统,SOD以超氧阴离子(O2·-)为底物,将其还原成H2O2,而H2O2继而可被CAT分解为水和氧气,也可被GSH-Px分解成水[24]。已有研究发现高浓度的疏水性胆汁酸具有细胞毒性,易造成部分肝脏机能的降低或缺失,影响SOD酶的生成,并且当机体受到严重胁迫时也会抑制SOD基因的表达[25]。本研究中,添加300 mg/kg胆汁酸时,牛蛙肝脏SOD活力显著降低,说明300 mg/kg的添加水平可能对试验牛蛙肝脏细胞产生毒性,从而降低SOD的活力。然而,在本研究中,200 mg/kg胆汁酸组牛蛙肝脏的SOD活力显著高于对照组,说明该剂量的胆汁酸对肝细胞没有明显的毒副作用,并且能提高牛蛙的抗氧化能力,抑制自由基产生,类似的结果在鸡的研究中也有报道[26]。谷胱甘肽过氧化物酶(GSH-Px)是动物体内重要的抗氧化酶,能特异性地催化谷胱甘肽还原、清除机体内有毒的过氧化物,保护生物膜和生物大分子免受氧化损伤[27]。试验结果显示,饲料中添加胆汁酸组牛蛙肝脏GSH-Px的活力均显著高于对照组,说明胆汁酸能增强机体对抗活性氧的能力。郭永丽等[28]在草鱼的研究中也有相似的结果。MDA是脂肪酸过氧化代谢产物,具有很强的生物毒性,是衡量肝脏受损伤程度的重要指标[29]。在本试验中,饲料中添加200 mg/kg胆汁酸显著降低了牛蛙肝脏MDA的含量,说明饲料中添加适量胆汁酸能降低牛蛙肝脏脂质过氧化作用,减轻生物毒性损伤。但结果表明,当添加量达到300 mg/kg时,MDA含量急剧上升,可能是高剂量疏水性胆汁酸改变了黄嘌呤脱氢酶的分子构象,暴露了氧化活化位点[30],使自由基增加,也可能是胆汁酸对肝细胞的毒性作用,抑制了抗氧化酶(如SOD酶)活力,不利于自由基的清除,最终导致MDA增加,具体机制还有待进一步研究。由此可见,饲料中添加适宜量的胆汁酸能够提高机体抗氧化酶能力,保护肝脏免受氧化损伤,而300 mg/kg以上的胆汁酸会加剧牛蛙肝脏氧化损伤。
3.4饲料中添加胆汁酸对牛蛙肝脏代谢酶的影响
谷草转氨酶(GOT)和谷丙转氨酶(GPT)是存在于细胞线粒体中的氨基转移酶,在心肌细胞和肝脏中活力最高。GOT主要催化α-酮戊二酸与天冬氨酸转氨基作用生成谷氨酸和草酰乙酸,而GPT主要在α-酮戊二酸和丙氨酸的转氨基过程起作用[31],其活力的高低反映肝脏对蛋白质的代谢强度。在本研究中,随着饲料胆汁酸添加量的升高,肝脏GOT活力表现出先升高再降低的趋势,当胆汁酸添加量为100 mg/kg时,GOT活力显著高于对照组,说明胆汁酸有利于提高肝细胞内氨基酸的代谢能力,这与汪军涛[26]的报道类似;而当添加量为300 mg/kg时,我们发现GOT活力显著降低,可能是鹅去氧胆酸对肝细胞线粒体产生了毒性[32],而GOT是存在于线粒体内的酶,因而其酶活力会受到鹅去氧胆酸的影响。肝脏不仅是氨基酸的代谢器官,也是机体进行脂肪酸β代谢和调节脂肪蓄积的主要器官,其中LPL和HL是参与脂肪分解的关键酶。LPL主要催化乳糜微粒和极低密度脂蛋白中甘油三酯水解,对机体脂质蓄积状况产生决定性作用[33]。郑珂珂等[34]发现,组织脂肪含量高能诱导LPL基因的表达,而本试验的结果也发现肝脏LPL活力与肝脂肪含量的变化趋势具有很高的一致性。这说明胆汁酸不是通过LPL和HL途径降低牛蛙肝脏脂肪的沉积。由此可见,饲料中添加适量的胆汁酸可增强牛蛙肝脏氨基酸代谢能力和不依赖于酯酶的脂肪调节能力。
3.5饲料中添加胆汁酸对牛蛙肝脏外部形态的影响
目前,脂肪肝或者脂肪肝病在养殖鱼类尚没有获得公认的客观标准[35]。在对人脂肪肝的诊断上,一般将肝脏粗脂肪含量(湿重)在5%-10%之间定性为轻度脂肪肝[36]。而动物的肝脏脂肪含量与其种类、食性[37]、性别[38]和生长阶段[39]有关,因此,确立牛蛙脂肪肝和脂肪肝病的判断标准,是将来需要开展的研究。在本试验中,饲料中添加300 mg/kg的胆汁酸组牛蛙肝脏质地偏硬,无弹性,表明肝脏可能有纤维化现象。已有研究表明,鹅去氧胆酸能间接激活表皮生长因子受体(EGFR)而上调肝细胞中的早期生长反应基因-1(Egr-1),而Egr-1能直接或间接作用增加肝细胞内某些促炎介质进而诱导肝纤维化[40]。本研究中高剂量胆汁酸组牛蛙肝脏抗氧化酶活力降低,MDA含量显著升高,说明高剂量疏水性胆汁酸可能诱导肝脏线粒体产生过量的活性氧,也有报道认为氧化应激和细胞器功能失调是造成肝纤维化的另一个重要原因[35],这些可能是摄食高剂量饲料胆汁酸的牛蛙肝脏变硬的原因。此外,有报道认为疏水性胆汁酸可通过多种途径诱导肝细胞损伤[27,41-42],因此,高剂量的胆汁酸对牛蛙肝脏细胞的毒性机制尚有待进一步研究。根据本试验的肝脏外部形态和生化指标分析结果,饲料中添加300 mg/kg胆汁酸会引起牛蛙肝脏组织纤维化。
4结论
饲料中添加适量的胆汁酸能通过调节牛蛙肝脏脂类代谢水平和抗氧化能力以维护肝细胞的正常功能,降低牛蛙脂肪肝发生的风险。饲料中300 mg/kg的胆汁酸添加量对牛蛙肝脏组织有明显的毒害作用。综合本研究结果,建议饲料中胆汁酸添加量不超过200 mg/kg。
参考文献:
[1]Camallero M J,Obach A,Rosenlund G.Impact of different dietary,lipid sources on growth,lipid digestibility,tissue fatty acid composition and histology of rainbow trout,Oncorhynchusmykiss[J].Aquaculture,2002,214(1):253-271.
[2]Yang S D,Lin T S,Liou C H,et al.Influence of dietary protein levels on growth performance,carcass composition and liver lipid classes of juvenileSpinibarbusHollandi(Oshima) [J].Aquacult Res,2003,34(8):661-666.
[3]张海涛,王安利,李国立,等.营养素对鱼类脂肪肝病变的影响[J].海洋通报,2004,23(1):82-89.
[4]Zhang C X,Huang K K,Wang L,et al.Apparent digestibility coefficients and amino acid availability of common protein ingredients in the diets of bullfrog,Rana(Lithobates)catesbeiana[J].Aquaculture,2015,437(1):38-45.
[5]Olvera-Novoa M A,Ontiveros-Escutia V M,Flores-Nava A.Optimum protein level for growth in juvenile bullfrog (RanacatesbeinanShaw,1802) [J].Aquaculture,2007,266(1-4):191-199.
[6]Carmona-Osade C,Olvera-Novoa M A,Rodeiguze-Serna M,et al.Estimation of the protein requirement for bullfrog (Ranacutesbeiana) tadpoles,and its effect on metamorphosis ratio [J].Aquaculture,1996,141(3):223-231.
[7]皇康康,张春晓,王玲,等.饲料蛋白质和脂肪水平对牛蛙生长性能的影响[J].水产学报,2014,38(6):877-887.
[8]Seixas-Filho J T,Hipolito M,Martins A M C R P F,et al.Histopathological alterations in bullfrog juveniles fed commercial rations of different crude protein levels [J].Revista Brasileira de Zootecnia,2009,38(12):2306-2310.
[9]Poupon R E,Chretien Y,Paumaartner G,et al.Serum bile acids in primary biliary cirrhosis:effect of ursodeoxycholic acid therapy [J].Hepatology,1993,17(4):599-604.
[10]王文花,祝丽丽,单泽松,等.猪去氧胆酸对体外培养肝癌细胞HepG2uPAR的影响[J].浙江中医药大学学报,2012,36(1):27-29.
[11]Watanabe S,Fujita K.Dietary hyodeoxycholic acid exerts hypolipidemic effects by reducing famesoid X receptor antagonist bile acids in mouse enterohepatic tissues [J].Lipid,2014,49(10):963-973.
[12]Jain A K,Stoll B,Douglas G,et al.Enteral bile acid treatment improves parenteral nutrition-related liver disease and intestinal mucosal atrophy in neonatal pigs [J].Physiol Gastrointest Liver Physiol,2012,302(2):218-224.
[13]Ferenc M,Ruchika S,Claire M,et al.New highly toxic bile acids derived from deoxycholic acid,chenodeoxycholic acid and lithocholic acid [J].Bioorg Medic Chem,2014,22(1):256-268.
[14]Barrasa J,Olmo N,Pablo P,et al.Deoxycholic and chenodeoxycholic bile acids induce apoptosis via oxidative stress in human colon adenocarcinoma cells [J].Apoptosis,2011,16(10):1054-1067.
[15]Song P,Zhang Y,Klaassen C D.Dose-response of five bile acids on serum and liver bile acid concentrations and hepatotoxicity in mice [J].Toxic Sci,2011,123(2):359-367.
[16]AOAC.Official methods of Analysis of AOAC International,18th edition [M].Gaithersburg MD:Association of Official Analytical Chemists International,2005.
[17]孙建珍,王际英,马晶晶,等.不同脂肪水平下添加胆汁酸对大菱鲆(Scophthalmusmaximus)幼鱼生长、体组成和脂肪代谢的影响[J].海洋与湖沼,2014,45(3):617-625.
[18]周书耘,刘永坚,梁海鸥,等.饲料中添加胆汁酸对军曹鱼生长及体组成的影响[J].南方水产,2010,6(4):20-25.
[19]杨敬辉,潘娟,刘占民.肝胆利康散、L-肉毒碱、胆汁酸对草鱼脂肪肝的治疗作用的比较[J].中国兽医杂志,2013,49(1):78-80.
[20]Gilat T,Leikin F A,Goldiner I,et al.Prevention of diet-induced fatty liver in experimental animals by the oral administration of a fatty acid bile acid conjugate (FABAC) [J].Hepatology,2003,38(2):436-442.
[21]Watananbe M,Houten S M,Mataki C,et al.Bile acids induce energy expenditure by promoting intracellular thyroid hormone activation [J].Nature,2006,439(7075):484-489.
[22]Rolo A P,Palmeira C M,Wallace K B.Mitochondrially mediated synergisic cell killing by bile acids [J].Biochim Biophys Acta,2003,1637(1):127-132.
[23]Joe A,Pichardo S,Prieto A I,et al.Toxic cyanobacterial cells containing microcystins induce oxidative stress in exposed tilapia fish (Oreochromis sp.) under laboratory conditions [J].Aquat Toxic,2005,72(3):261-271.
[24]Bakal A H,Hamelin M,Mary J,et al.Catalase,a target of glycation damage in rat liver mitochondria with aging [J].Biochimica Biophysica Acta,2012,1822(10):1527-1534.
[25]刘海映,张红,陈雷,等.盐度胁迫下口虾蛄Mn-SOD基因的表达分析[J].大连海洋大学学报,2013,29(1):17-21.
[26]Maria A,Rivoira A M,Marchionatti V A,et al.Sodium deoxycholate inhibits chick duodenal calcium absorption through oxidative stress and apoptosis [J].Comp Biochem Physiol,Part A,2012,162(4):397-405.
[27]徐辉碧,黄开勋.硒的化学、生物化学及其在生命科学的应用[M].武汉:华中理工大学出版社,1994:25-35.
[28]郭永丽,饶碧波,郭慧,等.胆汁酸添加剂对草鱼抗氧化能力的影响[J].广东农业科学,2009,(6):133-135.
[29]Mourente G,Tocher D R,Diaz E.Relationships between antioxidants,antioxidant enzyme activities and lipid peroxidation products during early development in dentex eggs and larvae [J].Aquaculture,1999,179(1):309-324.
[30]Mccord J M.Oxygen-derived free radicals in postischemic tissue injury[J].New Eng J Medic,1985,312(3):159-163.
[31]周顺伍,邹思湘,姜涌明,等.动物生物化学(第三版)[M].北京:中国农业出版社,2003:156-175.
[32]陆伦根,曾民德.胆汁酸对线粒体的毒性作用[J].肝脏,2008,13(4):343- 346.
[33]Auwerx J,Leroy P,Schoonjans K.Lipoprotein lipase:Recent contributions from molecular biology [J].Crit Rev Clin Lab Sci,1992,29(3-4):243-268.
[34]郑珂珂,朱晓鸣,韩冬,等.饲料脂肪水平对瓦氏黄颡鱼生长及脂蛋白酯酶基因表达的影响[J].水生生物学报,2010,34(4):815-821.
[35]杜震宇.养殖鱼类脂肪肝成因及相关思考[J].水产学报,2014,38(9):1628-1638.
[36]倪燕君.脂肪肝的发病机理和诊断治疗研究进展[J].国外医学:消化系疾病分册,1997,17(3):162-197.
[37]Wang J T,Liu Y J,Tian L X,et al.Effect of dietary lipid level on growth performance,lipid deposition,hepatic lipogenesis in juvenile cobia (Rachycentroncanadum) [J].Aquaculture,2005,249(1-4):439-447.
[38]Zhang W,Zhang Y,Zhang H,et al.Sex differences in transcriptional expression of FABPs in zebrafish liver after chronic perfluorononanoic acid exposure[J].Environ Sci Tech,2012,46(9):5175-5182.
[39]Hatlen B,Grisdale-Helland B,Helland S J.Growth,feed utilization and body composition in two size groups of Atlantic halibut (Hippoglossushippoglossus) fed diets differing in protein and carbohydrate content [J].Aquaculture,2005,249(3):401-408.
[40]庄卓男,张培健.早期生长反应因子-1对肝脏损伤的作用机制研究进展[J].医学研究生学报,2011,24(6):662-665.
[41]李静,夏正坤.内质网应激与膜性肾病[J].医学研究生学报,2011,24(5):542-545.
[42]Faubion W A,Guicciardi M E,Miyoshi H,et al.Toxic bile salts induce rodent hepatocyte apoptosis via direct activation of Fas [J].J Clin Invest,1999,103(1):137-145.
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!


