论文:罗非鱼湖病毒病及其检测技术研究进展
罗非鱼湖病毒病及其检测技术研究进展
李亚男,高峰,陈宗馥,李世娇,林蠡
(广东省水环境与水产品安全工程技术研究中心,广州市水产病害与水禽养殖重点实验室,仲恺农业工程学院动物科技学院,广东 广州 510225)
罗非鱼(Oreochroinis mossambicus)原产非洲,又名非洲鲫鱼,属鲈形目(Perciformes)、丽鱼科(Cichlidae),广泛分布于热带、亚热带的淡水和咸淡水交界水域。因其具有食性广、生长快、繁殖力和抗病能力强等特点,在养殖方面得到广泛推广,是全球重要的养殖鱼类之一,目前已在全世界85个国家和地区进行养殖。据联合国粮农组织(FAO)有关数据显示,2012年,全球罗非鱼的养殖产量达456万t,随后逐年递增,到2015年产量达到了640万t。我国罗非鱼养殖产量自2000年以来一直占世界罗非鱼总产量的50%以上,2017年,我国罗非鱼产量更是达到170多万t。然而,伴随着养殖密度的加大以及养殖过程中出现的水质恶化等一系列因素,罗非鱼病害也随之增多。
罗非鱼湖病毒(TiLV)是一种新型的单股负链RNA病毒,隶属于正黏病毒科(Orthomyxoviridae),可引起罗非鱼湖病毒病(TiLVD),该病可感染几乎所有的罗非鱼种类,致死率高达80%~100%。该病毒首次从2009年以色列、厄瓜多尔、埃及、泰国等地区暴发大规模罗非鱼死亡事件中被分离鉴定。世界动物卫生组织(OIE)、亚太地区水产养殖中心网(NACA)、FAO等多个国际组织,于2017年5月针对TiLV发布公告或预警。2018年起,我国海关总署、农业农村部也将TiLVD列为水产动物疫病检疫与监测对象。2020年7月,又将TiLVD列为二类动物疫病进行防控。鉴于TiLV对罗非鱼养殖业的严重威胁,现从TiLVD的流行病学研究、病原研究以及诊断与防治等方面进行综述,以期为TiLVD的基础研究和疫病防控提供相关参考。
1 罗非鱼湖病毒病及其流行病学研究
1.1 发现历史与地理分布
TiLVD最早暴发于以色列养殖和野生罗非鱼群体间,造成集体死亡。2011年,厄瓜多尔Chitralada品系罗非鱼以及尼罗罗非鱼暴发罗非鱼合胞体肝炎(SHT),之后经鉴定,均为TiLVD。2012—2016年夏,埃及暴发中、大规格尼罗罗非鱼死亡事件,平均死亡率达到9.2%。2015—2017年,泰国养殖的红罗非鱼和尼罗罗非鱼暴发“罗非鱼一个月死亡综合征(TOMMS)”,累计死亡率在20%~100%,后病原被证实为TiLV。
近年来,TiLVD呈逐年扩散趋势,自2014年起,亚洲、南美洲和非洲均已检测和分离出TiLV。到目前为止,TiLVD已在哥伦比亚、厄瓜多尔、以色列、埃及和泰国等国家流行,对马来西亚、印度、印度尼西亚、坦桑尼亚、乌干达、菲律宾和秘鲁等全球43个罗非鱼贸易频繁国家和地区造成严重经济损失。依据流行病学调查,推测包括中国在内的全球40多个国家的TiLV可能来自进口的泰国孵化场罗非鱼鱼苗。
1.2 临床特征
TiLV可以感染所有生命阶段的罗非鱼,特别是罗非鱼的早期发育阶段,患病鱼体的肝脏、脑、脾脏和头肾均可被感染。不同地区TiLVD的临床表现以及病变器官有所差异,这与病原毒株、其他病原混合感染、多种病原继发感染以及罗非鱼品种差异等因素相关,临床特征比较详见表1。
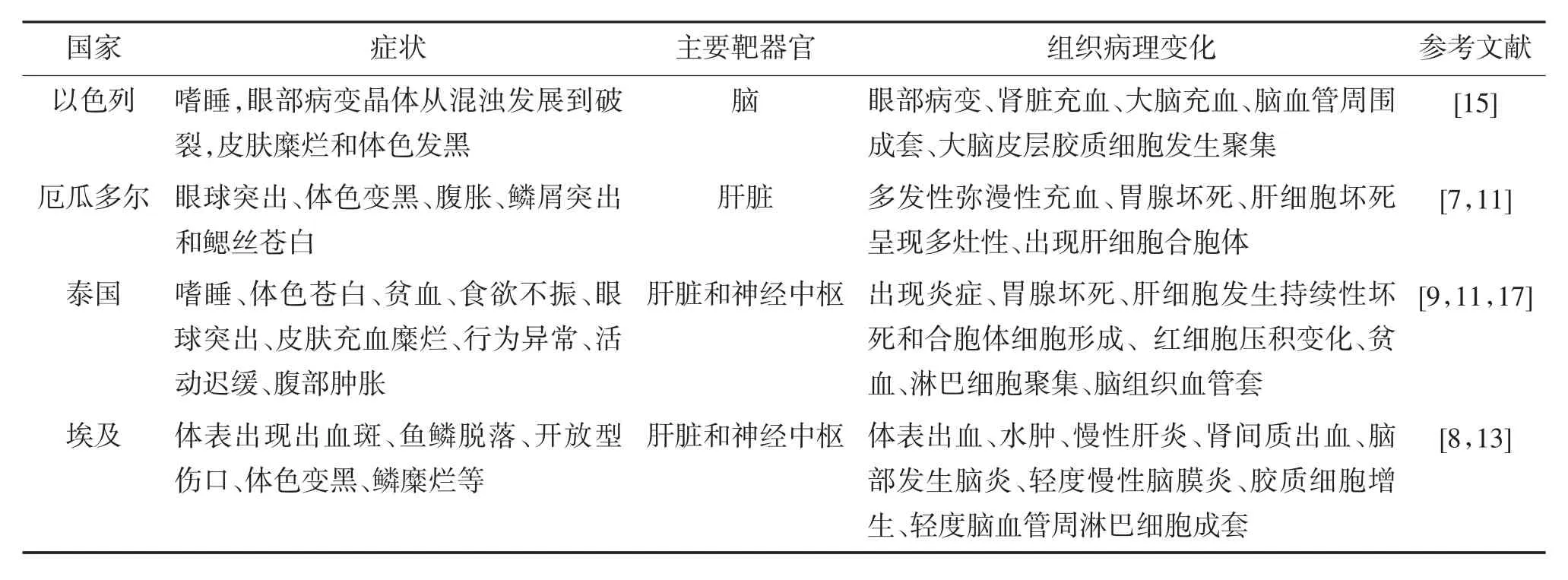
表1 不同地区TiLVD的临床特征比较
1.3 宿主范围
1.4 传播媒介
截至目前,TiLV的最初来源还未确定,已知唯一的传染源是野生或养殖的患病罗非鱼群。在其眼睛、大脑和肝脏内检出了高浓度的病毒,推测患病死亡的罗非鱼可能是重要的传播媒介。混养条件下,TiLV可在水体中进行直接传播。罗非鱼湖病毒在试验条件下可通过同居成功地将病毒传播给易感鱼类。此外,Pierezan等在试验条件下,采用灌胃的方法成功地再现了该疾病,在鱼类养殖池的粪便和污染水中检测到病毒,这高度提示了口腔—粪便传播途径。在最近的研究中也描述了TiLV的垂直传播。Eyngor等证明TiLV传播介质是水体,因此罗非鱼在进行交易和运输期间传播疾病的可能性很高;Fathi等提出鸟类的迁徙等多种途径可能对TiLV的传播发挥一定的作用,但该观点还未得到证明。
1.5 流行季节
2009年5—10月,以色列全境出现罗非鱼大量死亡的现象,发病水温22~32℃。埃及TiLVD暴发季节集中在6—10月,其间发病水温高于25℃,厄瓜多尔地区TiLVD发病时间集中在5—11月,水温25~27℃。在泰国10月至次年5月之间采样的罗非鱼中均发现TiLV阳性。另有研究表明,24~33℃时TiLV可增殖,最适温度25℃。由此可知,TiLVD常暴发于高温时期,热带地区全年均有感染的可能性,其他地区每年的5—10月可能是TiLV大规模暴发的关键期。此外,TiLV可在低温条件下存活,在-20℃冷冻保存的罗非鱼肉片内至少能存活28 d。
1.6 传入风险评估与管理
TiLVD属于近年来新发水生动物疫病,具有极强传染性,对罗非鱼的致死率可以达到20%~90%,给该产业带来巨大经济损失。世界各国对此高度重视,2017年5月,OIE、NANC、FAO、CGIAR(国际农业研究磋商组织)等多个国际组织发布公告,要求其所有成员国加强对TiLVD的检验防范工作。我国先后从多个国家引进优良罗非鱼品种进行繁育,目前是世界上最大的罗非鱼养殖国,年产量超过160万t。因此,对入境的水生动物进行TiLV检测和风险评估,可有效降低TiLV的传入风险。
风险评估是针对TiLV随水生动物及其产品传入我国引发疫病的可能性及后果进行分析,涉及危害识别、风险评估及风险管理三大方面。其中,危害识别主要是从病原、易感宿主、易感阶段及靶组织、传播媒介等几个方面对TiLV进行识别和预防风险评估,包括对TiLV传入的高、中、低类风险进行评估和判定。如活的敏感鱼类(亲鱼、鱼苗和鱼卵)、冰冻、冰鲜的敏感鱼类等,可能携带TiLV,且TiLV无法通过体表消毒进行消除;或者冰鲜鱼类在死亡之前已经携带TiLV,而TiLV可在低温下保存较长时间,因此此类动物属于高风险;中风险评估,如在水产养殖饲喂中使用到的鲜活饵料可能掺杂有携带TiLV的敏感鱼种,这些敏感鱼种可能是病原传入渠道之一;低风险评估包括对敏感鱼的各种加工产品、非敏感鱼的各种制品以及运输活鱼过程中所用到的工具等进行风险评估。目前对于TiLVD缺乏有效的治疗方法与疫苗,且TiLV易感性与罗非鱼种类关系密切,以上因素造成了该病的防治困难。应以预防为主,加强管理,措施如下:(1)严格遵循官方制定的卫生检测计划,定期开展苗种检测与生物防治;(2)定时进行渔场消毒与清洁;(3)积极开发高灵敏度诊断方法,提高疾病筛查效率;(4)及时捕杀患病罗非鱼,控制TiLVD的传播,防止疫病大规模暴发。
2 病原研究
2.1 病毒发现与命名
2009年,在以色列境内的淡水湖基内雷特湖首次发现TiLV并命名。之后发现,引起厄瓜多尔罗非鱼SHT的病毒基因组与TiLV相似,后被证实为TiLV。2015—2017年,泰国检测并分离得到TiLV毒株。2017年,在印度西孟加拉邦和喀拉拉邦两个州养殖的罗非鱼中也发现了TiLV。Dong等分析证实,TiLV在2012—2017年就已经呈现全球扩散趋势,秘鲁的TiLV毒株与以色列分离株Til-4-2011具有相同起源。
2.2 形态特征
TiLV是一种RNA单股负链病毒,国际病毒分类委员会将其暂定为新的正黏病毒物种,单列为罗非鱼病毒新属中的罗非鱼病毒种。电子显微镜下显示TiLV具包膜结构,形态通常为圆形到椭圆形二十面体,少有丝状或管状形态,大小55~75 nm,对乙醚和氯仿敏感。
2.3 感染偏好性
鱼体试验方面,通过混养和腹腔攻毒感染证实,罗非鱼及其杂交品种对TiLV敏感。TiLV也可引起其他鱼类发病,Jaemwimol等对10种养殖温水性鱼类进行TiLV敏感试验后发现,丝足鲈受感染后组织病理学损害显著,死亡率极高。Abdullah等研究发现,野生河鲤、鲶和孔雀鲈也受到TiLV较大影响。目前经研究证实,可与TiLV阳性罗非鱼混养的鱼类有鲤、灰鲻、细唇鲻、印度鲮、大鲤、珍珠斑、遮目鱼等。
细胞层面,TiLV可在尼罗罗非鱼(Ophicephalus striatus)的成纤维细胞(E-11)、罗非鱼的脑(OnlB、TiB)、肝脏(OnlL)、动脉球(OmB)和脑原代细胞(TmB)、杂交鳢脑细胞系(CAMB)中进行培养,最为合适的细胞系是E-11。其他的细胞系如来自大鳞大麻哈鱼(Oncorhynchus tshawytscha)的CHSE-214、蓝腮太阳鱼(Lepomis macrochirus)的BF-2等均不适宜进行TiLV的培养。
2.4 基因组学研究
第一个完成全基因组测定的罗湖病毒分离株是Til-4-2011,现被认定为标准毒株,具有10个基因组节段(Segment 1~10,S1~S10,GenBank登记号为KU751814~KU751823),基因组总大小为10 323 bp,从S1到S10片段大小逐个降低,S1长1 641 bp,S10只有465 bp。所有的基因片段均存在5'-GUAAUU...UUCAUC-3'的保守序列。10个片段中,S1片段编码蛋白与C型流感病毒的聚合酶PB1中保守氨基酸序列具有弱同源性,S4和S6片段可能分别编码TiLV的HEF蛋白和NP蛋白,但功能还需进一步确认,其余片段编码蛋白未发现与已知病毒存在同源性(表2)。到目前为止,包括Til-4-2011在内,已经有5个TiLV毒株完成了全基因组测序,60多个TiLV毒株完成了部分基因片段测序,分离出的毒株与Til-4-2011标准株同源性可以达到95%以上,基因序列特征十分相似。

表2 TiLV各片段研究进展[35,41-42]
2.5 致病机理
截至目前,对TiLV致病机理的研究报道十分有限。可以确定的是,当TiLV与其他细菌共同感染时,会加强TiLV对罗非鱼的危害程度。据泰国相关报道,在感染TiLV的罗非鱼体内还检测出了黄杆菌、气单胞菌和链球菌以及外源寄生虫和纤毛原生动物等。埃及、马来西亚等地养殖场的患病鱼体内也同时检测出多种气单胞菌共同感染的情况。因此,推测气单胞菌和TiLV可能存在协同作用,从而加强TiLV对于罗非鱼的危害,但具体机制尚不明晰。
TiLV还能以潜伏状态存在于患病罗非鱼体内。具体表现为:虽然TiLV检测呈阳性,但病毒载量较低,并未表现出明显的临床症状或只表现出亚临床感染症状,这可能是由于TiLV发生遗传变异所致。
3 诊断与防控
3.1 观察法
可通过观察法对鱼体是否患TiLVD进行初步判断。TiLVD典型临床症状包括昏睡、眼部病变、眼球突出、身体发黑、腹胀、鳞片突出、鱼鳃变白,皮肤糜烂、肾充血和脑炎等。组织病理学变化往往发生在肝脏和中枢神经系统中,如脑部水肿、组织充血;肝脏肿胀、细胞分离、合胞性肝炎等。由于不同地区、不同品系罗非鱼以及TiLV毒株有差异,可能会造成临床症状有差异。在以色列,养殖罗非鱼中受影响的鱼类表现出嗜睡、眼部改变、皮肤侵蚀和变色,而野生罗非鱼中仅描述了皮肤侵蚀和眼部病变。在厄瓜多尔,TiLV感染的临床体征包括眼球突出、皮肤变色、腹部发胀、鳞片突出和鱼鳃苍白,而在秘鲁的鱼类中已描述了溃疡和眼球突出。在泰国,病鱼表现出嗜睡、食欲不振、行为异常、贫血、鳃苍白、眼球突出、皮肤充血、腹部肿胀、糜烂等症状。在印度,自然感染病例出现皮肤侵蚀和鳞片脱落等症状,但在试验性感染鱼类时观察到眼球突出、腹部肿胀和鳞片突出等症状。在菲律宾,感染TiLV的鱼类的临床体征为腹部肿胀和眼睛肿胀。在埃及,受夏季死亡率影响的罗非鱼出现了出血斑、脱落鳞片、开放性伤口、暗变色等症状和鱼鳍腐烂病。
3.2 原位杂交法
原位杂交法具有灵敏度高、特异性强等优点,可用于分析保存样品中病毒核酸的回顾性调查,对于充分了解该病的历史流行情况具有重要意义。另外,不同的TiLV地理株感染靶组织可能存在差异,原位杂交法可用于精确定位感染靶组织。例如,利用原位杂交法,检测出泰国患病罗非鱼的主要感染组织为肝、肾以及鳃组织,而厄瓜多尔TiLV主要作用的靶器官是胃肠道和肝脏。
3.3 PCR法
目前,可用于检测TiLV的方法有RT-PCR法、巢式RT-PCR法、荧光RT-PCR法、环介导等温扩增反应(LAMP)等。2014年,Eyngor等开发了用于TiLV检测的RT-PCR方法,该方法有较强的特异性和较高的敏感性,可在短时间内检测大量临床样品,适用于批量临床样本检测和流行病学监测。Tsofack等建立了一种更为敏感的巢式RT-PCR方法,检测限可达7个拷贝的病毒粒子,该方法能够对样品中病原数量进行定量,且快速、准确、灵敏度高,现已被开发用于检测多种鱼类病毒病。随后,Dong等发表了一种改进的半巢式RT-PCR检测方法,省略了引物“nested ext-2”,可有效避免假阳性结果,检测的灵敏度高于qRT-PCR方法,与巢式RT-PCR相当。2019年,Phusantisampan等和Yin等等建立了TiLV的荧光RT-LAMP快检方法,该方法特异性好,灵敏度是半巢式RT-PCR方法的4倍,检测限低至1.6个拷贝数的病毒粒子,为TiLV的现场快速检测提供了一种准确可靠的方法。LAMP法作为一种全新的恒温核酸扩增方法,虽然引物设计较为复杂,但操作简单,对于实验器材要求不高,反应产物用肉眼可见,具有效果明显、成本低廉,实用性更强的特点,可用于TiLV的现场快速检测。
3.4 防控措施
目前,TiLVD疫情还未见行之有效的治疗方法,因此精准防控至关重要。首先,考虑到不同品种罗非鱼对TiLV的敏感性有差异,建议养殖时避开敏感品种。另外,从苗种到成鱼的养殖过程中,应采取有效的生物控制措施,改善养殖环境,减少病原微生物种类和数量,以避免降低鱼体免疫力、增加TiLV感染风险;配合使用免疫增强剂,提高鱼体抗病能力;养殖过程中,经常进行TiLV监测,及时发现和控制传染源,防止疫病大规模流行。最后,加强TiLV的诊断技术研究,加快开发精准、廉价、便捷的现场快检技术与产品;并积极推进相关疫苗研发。
4 建议
TiLVD为近年来新发重大疫病,目前已在全球范围内流行,给罗非鱼养殖产业带来了巨大的经济损失。今后对于TiLVD相关研究,应重点从以下几方面开展:
(1)目前缺乏有效的TiLVD化学治疗方法和疫苗,应时刻保持警惕,以预防为主,积极开展TiLVD流行病学调查,明确发病条件、流行规律以及传播途径等;推进病原研究,病毒的分离、传播、复制、致病机理等是下一步需要重点关注的问题;以感染TiLV后存活下来的罗非鱼为切入点,深入分析对病原的免疫应答差异,尽快研制出TiLV疫苗。
(2)由于各地区发现的TiLV毒株不同,首先应充分调查各种毒株相对应的罗非鱼敏感品系,在此基础上,尽量避免养殖TiLV易感品种,并积极进行品种改良。
(3)加强罗非鱼生物安保措施管理与传播风险评价体系建设。加强养殖管理,开展养殖环境监测,及时发现、切断传染源,尤其要加强罗非鱼苗种厂的监测管理与消毒。另外,由于我国每年都需要从国外引进罗非鱼良种、冰冻和冰鲜敏感鱼类以及用作活饵料的野杂鱼等,存在TiLV通过国际贸易传入的潜在风险。对此,应督促各贸易国严格遵守世界动物卫生组织发布的《水生动物卫生法典》,加强入境产品有效检疫,阻断TiLV在国际贸易中传播。
(4)TiLV属于RNA病毒,变异快,且在不同地理条件下基因组存在显著差异。应及时更新序列信息,改进诊断方法,正确区分不同地理株,开发更为精准、低价的快检技术与产品。
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼第一线"微信公众帐号和微信视频号"养鱼第一线刘文俊视频号"以及头条号"水花鱼@渔人刘文俊"!


