论文:斑点叉尾“腹水症”病原的分离鉴定及体外芽孢杆菌拮抗试验
斑点叉尾“腹水症”病原的分离鉴定及体外芽孢杆菌拮抗试验
王亚军,魏文娟,潘厚军,颜 曦,王 芳,石存斌
(中国水产科学研究院珠江水产研究所,农业部渔用药物创制重点实验室,广东省水产动物免疫技术重点实验室,广州 510380)
1 实验材料与方法
1.1 实验鱼
1.2 试剂与菌株材料
普通营养琼脂培养基、水解酪蛋白 (MH) 琼脂、LB培养基购自北京陆桥技术有限责任公司;5%羊血琼脂培养基购自广州市迪景微生物科技有限公司;革兰染色试剂盒购自厦门迈威生物科技有限公司;细菌鉴定试剂条及相关配套试剂均购自法国梅里埃公司(BioMereux);细菌DNA提取试剂盒购自北京全式金生物技术有限公司;PCR扩增引物由生工生物工程技术服务有限公司合成;药敏纸片为英国Oxid产品;基因测序由广州艾基生物有限公司进行。
地衣芽孢杆菌(Bacilluslicheniformis)Bl160913株、枯草芽孢杆菌(Bacillussubtilis)Bs160913株、短小芽孢杆菌(Bacilluspumilus)Bp160913株和解淀粉芽孢杆菌(Bacillusamyloliquefaciens)Ba160912株4株芽孢杆菌均由本实验室分离、鉴定和保存。
1.3 病原菌的分离
将发病鱼按常规方法剖检,无菌条件下从病鱼的肝脏、脾脏、肾脏等病灶组织取样,分别在普通营养琼脂培养基和兔血琼脂培养基上划线接种,28 ℃培养24 h,挑选大小形态一致的优势菌落再纯化,分离得到优势菌1株,转接普通营养琼脂平板,4 ℃保存备用[9]。
1.4 病原菌的鉴定
1.4.1 革兰氏染色鉴定
无菌条件下在洁净的载玻片上滴少许生理盐水,用接菌环将分离纯化后的单菌落均匀地涂布到盛有生理盐水的载玻片上,待其自然风干后,用结晶紫染液对其初染1 min,再用碘液媒染 1 min,后用脱色液脱色20~30 s,最后用番红染色进行复染1 min,镜检。
1.4.2 生化鉴定
按照《常见细菌系统鉴定手册》[10],根据革兰氏染色结果选用BioMereux ID 32 GN(革兰氏阴性杆菌鉴定试剂条及配套试剂),检测优势菌株的生化特性[11]。
1.4.3 分子生物学鉴定及系统发育树的构建
根据DNA提取试剂盒说明提取优势菌株DNA。利用Primer 5.0 软件设计16S rDNA基因扩增所用引物和gyrB基因扩增引物,16S rDNA上下游引物序列分别为:27F:5′AGAGTTTGATCCTGGCTCAG 3′,1492R :5′GGTTACCTTGTTACGACTT 3′;gyrB上下游引物序列分别为:F:5’-TCCGGCGGTCTGCACGGCGT-3′,R:5′-TTGTCCGGGTTGTACTCGTC-3′ 。PCR反应体系均为:上下游引物各1.0 μL,mix 11.0 μl,ddH2O 10.0 μL,DNA模板 2.0 μL。扩增16S rDNA PCR反应程序:94 ℃ 5 min;94 ℃1 min,55 ℃ 1 min,72 ℃ 90 s,30个循环;72 ℃ 7 min 。扩增gyrB PCR反应程序:94 ℃ 4 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。
PCR反应产物经琼脂糖凝胶电泳检测、送广州艾基生物技术公司测序,将所得到的gyrB DNA序列运用NCBI的BLAST程序在Genbank进行同源序列比对并利用MEGA 7.0构建系统发育进化树[12-13]。
1.5 回归感染
1.6 药敏试验
将纯化得到的细菌接种于LB液体培养基,28 ℃震荡(200 r/min)培养4 h,用无菌生理盐水稀释菌液,达到0.5个麦氏浊度,再按1∶100稀释菌液至含菌量约为1.5 × 106CFU /mL。混匀取100 μL至MH培养基平板中涂布均匀,其上放置药敏纸片, 28 ℃培养20 h后测量不同药物的抑菌圈直径(mm),参照美国临床实验室标准化委员会(Clinical and Laboratory Standards Institute,CLSI) 文件标准判断致病菌株对药物的敏感程度[14 -16]。
1.7 芽孢杆菌的拮抗作用
分别将短小芽孢杆菌Bp160913株、枯草芽孢杆菌Bs160913株、地衣芽孢杆菌Bl160913株及解淀粉芽孢杆菌Ba160912株接种到装有5.0 mL LB液体培养基试管中,37 ℃, 160 r/min振荡培养4 h,用无菌生理盐水稀释各菌液,均达到0.5麦氏浊度。将分离纯化的分离菌单菌落接种到装有5.0 mL营养肉汤液体培养基试管中,置37 ℃,160 r/min振荡培养4 h后,用无菌生理盐水稀释菌液,达到0.5麦氏浊度,取出10 μL稀释100倍均匀涂布MH 平板,静待一段时间后,其上放置牛津杯,轻轻加压使其与培养基完全紧密结合,防止漏液,在牛津杯中加入150 μL不同种的芽孢杆菌培养液,在28 ℃培养箱中培养24 h,测定抑菌圈的直径。
2 结果
2.1 病原菌的分离与革兰氏染色
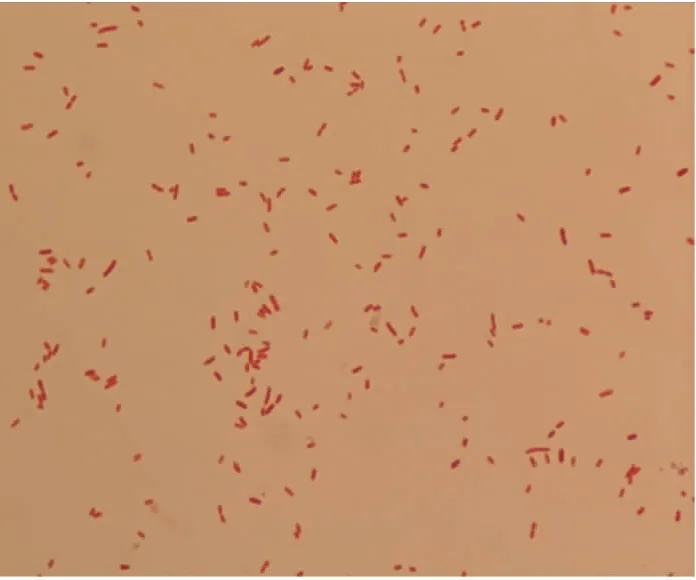
图1 菌株cw-1革兰氏染色结果Fig.1 Gram staining results of strain cw-1
2.2 生化鉴定
菌株cw-1生理生化鉴定特性见表1, D-葡萄糖、脯氨酸、D-甘露醇等反应呈阳性,而D-蜜二糖、肌醇和L-鼠李糖等反应呈阴性,根据鉴定百分率(%id)为99.9,T(期望值)为0.88,以及无不符试验,初步鉴定分离菌株为温和气单胞菌(Aeromonassobria)。

表1 分离菌株cw-1的生化特性Tab.1 Biochemical characteristics of cw-1 strains isolated from Ictalurus punctatus
注: “+”—阳性;“-”—阴性;d.75%阳性。

图2 cw-1菌株16S rDNA基因PCR扩增电泳图 Fig.2 The PCR products for 16S rDNA gene of cw-1 strain
2.3 分子生物学鉴定
PCR扩增cw-1的16S rDNA基因(图2),经测序和Genbank比对,比对结果表明分离菌株cw-1属于气单胞菌类,相似度达到99%。对其gyrB基因进行PCR扩增,结果显示扩增的基因长度约为1 040 bp(图3)。根据gyrB基因序列构建的系统进化树,发现菌株cw-1与温和气单胞菌的亲缘关系最近,自然聚类为一支(图4),说明该菌株确为温和气单胞菌。

图3 cw-1 gyrB基因PCR扩增电泳图Fig.3 The PCR Products for gyrB Gene of cw-1 strain

图4 cw-1菌株 gyrB基因系统发育树Fig.4 Phylogenetic tree of gyrB gene of cw-1 strain线长代表遗传距离
2.4 回归感染

表2 回归感染结果Tab.2 Results of the recurrent infection
2.5 药敏试验结果
通过纸片扩展法测试了菌株cw-1对10种常见药物敏感性,具体结果见表3。菌株cw-1对恩诺沙星、氟苯尼考、氧氟沙星等6种药物敏感,对磺胺复合药物和链霉素中度敏感,而对四环素、强力霉素耐药。

表3 药敏实验结果Tab.3 Results of the drug sensitivity test
注: S—敏感 (直径>17 mm); I—中度敏感 (13 mm≤直径≤17 mm); R—不敏感(耐药)(直径<13 mm)
2.6 芽孢杆菌的拮抗结果
3 讨论
温和气单胞菌属弧菌科,革兰氏阴性菌,是一种条件致病菌,分布广泛,其主要致病因子包含肠毒素、溶血素等,感染后发病率高、发病迅速及死亡快[17],常引起水生动物大规模发病,是危害我国水产养殖业的重要病原菌之一[18]。本实验从患“腹水症”的斑点叉尾上分离出的菌株为温和气单胞菌,此结果与韦昌用等[19]报道的腹水病病原一致,虽与钟妮娜等[20]报道的腹水症病原不同,与苏应兵等[2]报道的暴发性败血症病原也不完全一致,但发病斑点叉尾所表现出的“腹水”、眼球突出、内脏肿大等症状相似。据以往的报道,高温季节温和气单胞菌与嗜水气单胞菌常单独或者混合感染[21-22],引起的症状也相似,这可能是本实验与以上报道的“腹水症”病原存在不一致情况的原因。

表4 芽孢杆菌的拮抗作用Tab.4 Antagonism of Bacillus mm
注:牛津杯直径7 mm
16S rDNA序列分析已成为细菌种属鉴定和分类的标准方法[23],但这种细菌分析方法存在一定的局限性,只能在细菌属的水平上区分。gyrB基因是一种可以编码蛋白的基因,此基因存在于大多数细菌中,在细菌的系统发育学,特别是在近缘种和菌株的区分及鉴定方面受到高度关注[24,25],Soler等[26]研究发现gyrB基因对相近的种具有很高的分辨率,本实验先采用16S rDNA基因进行分离菌株属的鉴定,确定发病斑点叉尾其病原为气单胞菌类,其后用gyrB基因扩增鉴定菌株,进一步确定菌株为温和气单胞菌。
根据药敏实验结果,菌株对强力霉素和四环素产生耐药性,而对此实验中其他8种常用药物均有敏感性,说明此养殖场尚未滥用药物,在养殖过程中若发生此类细菌引起的疾病,可根据实际情况合理使用氟苯尼考等药物治疗,但要注意避免长期使用同一种药物,以防病原菌产生耐药性而导致防治无效[27]。由于抗生素滥用造成的弊端,近几年生物防治和生态防治日渐兴起[28],据报道,芽孢杆菌能分泌一种具有抑菌活性的抑菌物质[29],解淀粉芽孢杆菌对嗜水气单胞菌具有明显的拮抗作用,将其作为益生菌添加剂添加到饲料中用于动物生产,不仅有较好防病效果还可提高动物生产性能[30-32]。本实验结果发现不同种芽孢杆菌对温和气单胞菌均有拮抗作用,但拮抗作用大小不同,地衣芽孢杆菌及解淀粉芽孢杆菌作用较为显著,下一步应定量分析芽孢杆菌拮抗温和气单胞菌的数量的关系,及其抗菌活性物质及抗菌机理。
参考文献:
[1]雷晓中,蔡焰值,汪 亮.斑点叉尾无公害高效养殖技术概要[J].湖北农业科学,2013,52(10):2377-2379.
[2]苏应兵,邹桂伟,袁科平,等.斑点叉尾暴发性败血症病原的分离与鉴定[J].淡水渔业,2006,36(5):37-41.
[3]陈红莲,王永杰,陈 宇,等.患爆发性败血症斑点叉尾病原的分离与鉴定[J].安徽农业大学学报,2014,41(1):24-29.
[4]刘 韬,王二龙,汪开毓,等.河南中牟地区斑点叉尾突发性败血症病原分离及鉴定[J].中国预防兽医学报,2016,38(1):53-57.
[5]余晓丽,陈 明,李 超,等.斑点叉尾暴发性海豚链球菌病的研究[J].大连水产学院学报,2008,23(3):185-191.
[6]邓显文,谢芝勋,刘加波,等.广西斑点叉尾爱德华氏菌的分离鉴定[J].广西农业科学,2008,39(2):231-235.
[7]刘金玉,杨五名,李爱华,等.斑点叉尾套肠症的病原学初步研究[J].水生生物学报,2008,32(6):824-831.
[8]杨移斌,刘天强,阳 涛,等.斑点叉尾冬季大规模死亡病原分离与鉴定[J].中国渔业质量与标准,2016,6(6):53-58.
[9]耿 毅,汪开毓,陈德芳,等.斑点叉尾一株致病菌的分离鉴定及系统发育分析[J].微生物学报,2006,46(4):649-652.
[10]东秀珠,蔡妙英.常见细菌系统鉴定手册[M] .北京:科学出版社,2001
[11]肖 宁,孔令严,周 昊,等.克氏原螯虾病原弗氏柠檬酸杆菌的分离鉴定及其药敏与黏附特性[J].水产学报,2016,40(6):946-955.
[12]Theodore S,Coenye T,Vandamme P,et al.PCR-based assay for differentiation ofPseudomonasspecies from otherPseudomonasspecies recovered from Cystic Fibrosis Patients [J].J Clin Microbiol,2004,42(5):2074-2079.
[13] 远 方,屈淑平,崔崇士,等.一株新的胡萝卜软腐欧文氏菌的分离和鉴定[J].微生物学报,2004,44(2):136-140.
[14] Balouiri M,Sadiki M,Ibnsouda S K.Methods forinvitroevaluating antimicrobial activity:A review[J].J Pharm Anal ,2016,6(2):71-79
[15]胡大胜,黄 钧,罗振海,等.广西水产养殖主要细菌病的监测与耐药性调查[J].中国科技成果,2010,11(13) :49-51.
[16]郑国兴,周 凯.嗜水气单胞菌欧洲鳗皮肤溃疡分离株的耐药性[J].中国水产科学,1999,6 (3) :67-71.
[17]何长民.医用微生物学实验技术 [M].兰州:甘肃人民出版社,1981.
[18]陈 瑞.抗嗜水气单胞菌单克隆抗体和抗温和气单胞菌单克隆抗体的制备及鉴定 [D].西安:第四军医大学,2007.
[19]韦昌用,彭 亚,刘 杰,等.斑点叉尾腹水病病原菌分离鉴定及药敏试验[J].南方农业学报,2014,45(5):875-881.
[20]钟妮娜,汪开毓,罗碧平,等.斑点叉尾“腹水症”病原分离及免疫研究[J].中国兽医杂志,2002,38(9):40-41.
[21]唐江芳.气单胞菌及其在水产中的危害[J].河北渔业,2007(3):5-6,11.
[22]宋浩刚,吴亚峰,沈剑强,等.南京某集贸市场淡水鱼感染嗜水气单胞菌的鉴定及毒力因子检测[J].中国兽医科学,2011,41 (2) :111-115.
[23]朱诗应,戚中田.16S rDNA扩增及测序在细菌鉴定与分类中的应用[J].微生物与感染,2013,8(2):104-109
[24]侯晓丽,陈 智.分类及鉴别细菌的新靶标-gyrB基因[J].国外医学:流行病学传染病学分册,2005,32(1):38-41.
[25]安 然,易图永,肖启明,等.gyrB基因在细菌分类和检测中的应用[J].江西农业学报,2010,(4):18-20,24.
[26]Soler L,Yanez M A.,Chacon M R.,et al.Phylogenetic analysis of the genus aeromonas based on two house keeping genes[J].Int J Syst Evol Micr,2004,54(5):1511-1519.
[27]陈昌福,毛芝娟,王 敏.福建爱德华氏菌对土霉素、氯霉素和链霉素的感受性、耐药性研究[J].淡水渔业,1996,26 (3):3-6.
[28]陈 营,王福强,王 凡.牙鲆肠道内弧菌拮抗菌的分离与筛选[J].海洋科学,2003,27(3):43-46.
[29]Sugita H,Hirose Y,Matsuo N,et al.Production of the antibacterial substance byBacillussp.strain NM 12,an intestinal bacterium of Japanese coastal fish[J].Aquaculture,1998(3-4),165:269-280.
[30]曹海鹏,何 珊,刘丽玲,等.鲟源病原性嗜水气单胞菌拮抗芽孢杆菌的鉴定及其生物学特性[J].微生物学通报,2011,38(9):1377-1384.
[31]Kaewklom S,Lumlert S,Kraikul W,et al.Control ofListeriamonocytogeneson sliced bologna sausage using a novel bacteriocin,amysin,produced byBacillusamyloliqufaciensisolated from Thai shrimp paste (Kapi)[J],Food Control,2013,32(2):552-557.
[32]朱芝秀,蒋新华,邓舜洲,等.解淀粉芽孢杆菌的分离鉴定及其对嗜水气单胞菌抑制作用研究[J].中国畜牧兽医,2015,42(3):734-740.
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!


