论文:工厂化循环水养殖系统微生物群落结构和功能分析
工厂化循环水养殖系统微生物群落结构和功能分析
熊向英,王志成,刘旭佳,姚坤志,梁志辉
( 1.广西海洋研究所有限责任公司,广西 北海 536000;2.广西科学院 广西北部湾海洋研究中心,广西近海海洋环境科学重点实验室,广西 南宁 530007 )
传统渔业易造成环境污染、水资源短缺以及水产品质量安全等一系列问题。循环水养殖系统作为高密度集约化养鱼的一种技术,可以在水资源利用率受到限制的情况下,通过许多不同的水处理方法使90%~99%的水得到循环利用[1],是未来水产养殖模式的发展趋势。在欧美等发达国家,循环水养殖已相对成熟。在我国,循环水养殖近些年也得到了快速的发展。据2020年中国渔业统计年鉴资料,我国工厂化养殖2019年的产量达5.42×105t,其中山东和福建的产量占全国总量超过50%,达3.12×105t,主要集中在鲆鲽类、鲟鱼、虹鳟(Oncorhynchusmykiss)、石斑鱼和对虾等产业[2-3]。笔者所在研究团队建立了一套适合应用于广西地区的工厂化循环水养殖系统,以近年来中国南方地区人工养殖常见品种红鳍笛鲷(Lutjanuserythropterus)和珍珠龙胆石斑鱼(Epinephelusfuscoguttatus♂×E.lanceolatu♀)为养殖对象,在常规的水处理部分设计了沉淀池、蛋白分离池、生物过滤池外,还设计了海马齿(Sesuviumportulacastrum)浮床池。海马齿根系可对养殖水体中悬浮颗粒物起到清除作用[4],并具有可充分利用环境中营养盐的生长优势[5],以达到生态修复的目的。
水产养殖中水质变化与环境微生物紧密相关,微生物群落结构会随着养殖环境水体理化性质的改变而改变[6],而相比于更开放的养殖系统,微生物群落在循环水养殖中发挥的作用更加重要[7]。全面解析循环水系统中各水处理单元细菌群落组成,比较各单元细菌群落组成、物种多样性和功能的差异,可为构建健康循环水养殖系统提供理论依据。目前关于循环水系统细菌群落的研究方法包括PCR-DGGE[8-9]、16S rRNA基因克隆文库[10]等传统方法及基于高通量测序[11-12]的现代技术,且多集中于分析循环水生物滤池中生物载体上的微生物群落,而鲜见关于循环水系统中各单元之间细菌群落变化和功能方面的研究。笔者对该系统各水处理的单元水样进行基于Illumina HiSeq测序平台的高通量测序,分析其细菌群落结构和组成,并通过PICRUSt进行菌群功能预测,以期探索循环水系统中细菌群落结构和功能的变化,结果将有助于构建健康的、适合于中国南方地区养殖的循环水养殖系统。
1 材料与方法
1.1 试验系统与养殖管理
循环水养殖系统建于广西北海市广西海洋研究所海水增养殖基地试验车间,该车间用于试验养殖的水池13口,每口池面积5.1 m×3.4 m,养殖水深90 cm,有效养殖水体15.6 m3/口。自动沉降池2口,蛋白分离器占1口池,生物过滤系统经3口池改造,海马齿浮床和紫外杀菌池各1口。生物过滤系统有A、B、C 3个过滤通道,每个通道又分别有三级生物过滤池,其中:A、B两个通道相同,采用商品滤料,珊瑚石作为一、二级生物过滤,生化球作为三级过滤;C通道由珊瑚石作为一级过滤,椰子壳碎作为二、三级过滤。海马齿浮床池用平均长度5~10 cm、茎节数3~4节的枝条进行扦插,保证1~2个茎节在水面下,便于其正常生根,共放有6个浮床,每个浮床约300个扦插植株。循环水养殖系统处理顺序为鱼池→沉淀池→蛋白分离器→生物滤池→海马齿浮床→紫外杀菌→鱼池(图1)。
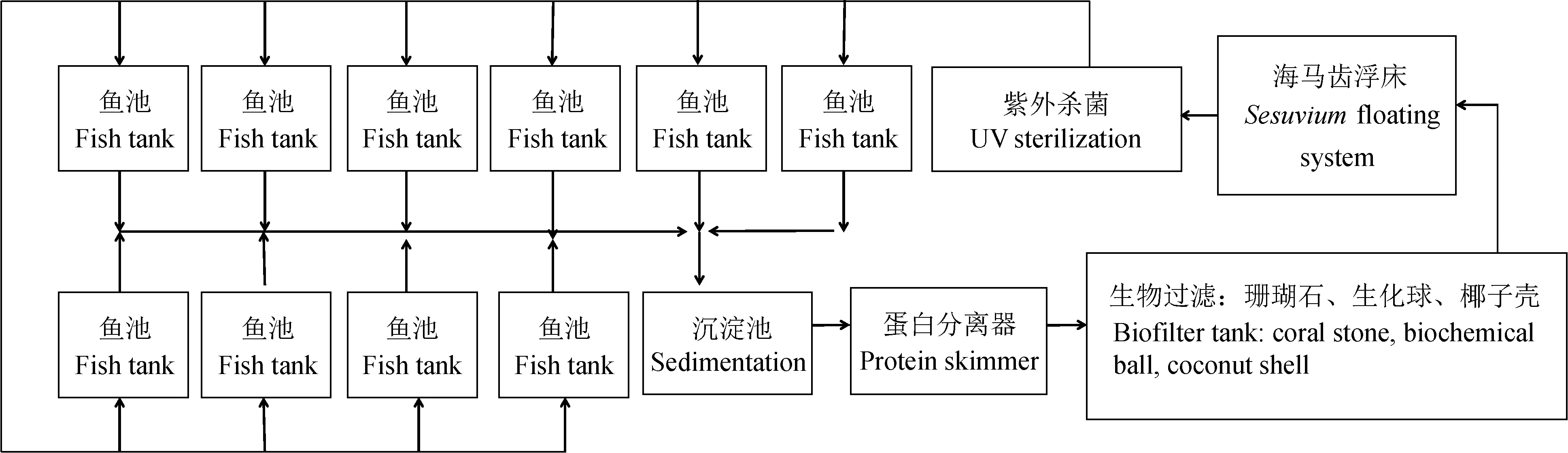
图1 循环水养殖系统示意Fig.1 Schematic diagram of circulating aquaculture system
养殖品种为广西养殖较多的珍珠龙胆石斑鱼和红鳍笛鲷,养殖试验周期为2018年8月22日—9月21日。珍珠龙胆石斑鱼的养殖密度71尾/m3,平均体长15.9 cm,体质量136.4 g;红鳍笛鲷的密度160尾/m3,平均体长11.4 cm,体质量42.1 g。养殖期间每日8:00和17:00定时投喂,投喂量约为鱼体质量3%~5%,摄食不佳时,及时调整投喂量。试验期间循环水养殖系统水质条件为:水温28.5~31.4 ℃,溶解氧质量浓度7.87~9.05 mg/L,盐度28~31,pH 7.8~8.1。
1.2 样品采集和水质分析
取样时间点为挂膜30 d水质稳定后,此时生物滤池挂膜基本完成。各池取3个点,混合作为1个样品,用抽滤泵过滤水样后进行水质分析。采用清时捷TA-90紫外可见分光光度计测定营养盐含量:氨氮含量采用纳氏试剂分光光度法测量;亚硝态氮含量采用重氮偶合分光光度法测量;硝态氮含量采用麝香草酚分光光度法测量;化学需氧量采用碱性高锰酸钾法测量;磷酸盐采用磷钼蓝分光光度法测量。高通量测序分析采用多点取样法取水样,每池共取3 L水样,共采集6个样品,分别为珍珠龙胆石斑鱼池、红鳍笛鲷池、沉淀池、蛋白分离池、生物滤池、海马齿浮床池。所有样品采集后立即放入冰盒中带回实验室做后续处理。
1.3 样品DNA提取、PCR扩增及高通量测序
将每口池3 L水样混匀后,取其中1 L水样先经5 μm孔径的混合纤维膜预过滤去除杂质后用0.22 μm无菌聚醚砜膜(津腾,中国)进行抽滤,将带有水体菌体的滤膜剪碎,用E.Z.N.A Water DNA Extraction Kit试剂盒(Omega Bio-Tek,USA)提取。对16S rRNA基因可变区V3~V4区进行PCR扩增,所用引物序列为细菌特异性引物:341F(5′-CCTAYGGGRBGCASCAG-3′)和806R(5′-GGACTACNNGGGTATCTA AT-3′)。PCR产物使用2%的琼脂糖凝胶电泳检测,送百迈克生物信息公司(北京)进行基于Illumina HiSeq测序平台,利用双末端测序的方法,构建小片段文库进行测序。
1.4 数据分析
对原始测序序列使用FLASH 1.2.11软件进行拼接,将拼接得到的序列使用Trimmomatic 0.33软件进行质量过滤,并利用UCHIME 8.1软件去除嵌合体,得到高质量序列(Tags)。分析过程中删除了古菌、叶绿体、未知序列以及只检测到1次的序列。利用USEARCH 10.0软件对所有样品的Tags进行聚类,默认以97%的一致性将序列聚类成为运算分类单元(OTU),与SILVA的SSUrRNA数据库对其进行物种注释分析。通过α多样性分析,统计各样品在97%相似度水平下的Ace、Chaol、香农及辛普森指数,绘制样品等级丰度曲线,研究单个样品内部的物种多样性。将测序数据经过Greengenes database 13.8数据库比对后生成得运算分类单元表,根据其16S rRNA基因拷贝数划分的每个运算分类单元丰度将其均一化,再利用PICRUSt(http:// picrust.github.io/picrust/)分析获得京都基因和基因组百科全书(KEGG)群落功能分类信息,对样品进行基因功能预测并计算功能基因丰度。
2 结 果
2.1 水质分析结果
由水质分析结果(表1)可知:各水质指标在养殖池水经过沉淀池后均大幅降低,化学需氧量、氨氮、硝态氮、亚硝态氮和磷酸盐去除率分别为58.44%、54.27%、65.64%、40.39%、70.21%;经过蛋白分离池又有小幅度的升高,经过生物滤池后化学需氧量、氨氮、硝态氮、亚硝态氮和磷酸盐质量浓度分别下降了14.12%、4.96%、36.78%、22.09%和36.78%;经过海马齿浮床池后,化学需氧量、硝态氮、亚硝态氮又降低了18.04%、10.00%和34.37%,但氨氮和磷酸盐质量浓度反而升高了30.60%和12.73%。

表1 各样品的水质指标 mg/LTab.1 Water quality indices of each sample
2.2 高通量测序结果
6个样品以97%相似性水平划分运算操作分类单元,珍珠龙胆石斑鱼池、红鳍笛鲷池、沉淀池、蛋白分离池、生物滤池、海马齿浮床池中有效运算分类单元数目分别为470、468、513、510、406和543个。
2.3 循环水养殖系统各单元微生物群落分析
运算分类单元物种注释结果显示,在门分类水平上优势细菌主要为变形菌门、拟杆菌门和疣微菌门,这3个门类在除海马齿浮床池外的其他池中相对丰度总和均达到90%以上,在海马齿浮床池中也达到76.64%。另外海马齿浮床池中相对丰度较高的细菌还有绿弯菌门(6.66%)、酸杆菌门(4.42%)和放线菌门(3.10%)。变形菌门在各池中均为最优势细菌种类,占比为47.45%~85.66%,但在各池中差异显著,其中在红鳍笛鲷池相对丰度高达85.66%,而在生物滤池和海马齿浮床池中仅有49.36%和47.45%(图2a)。进一步从纲分类水平上分析发现,α-变形菌纲在生物滤池和海马齿浮床池中的减少是造成这种差异的主要原因(图2b)。拟杆菌门在各样品中为占比次优的细菌门类,相对丰度变化为5.23%~23.51%。拟杆菌门在各池之间也有明显差异,在生物滤池和海马齿浮床池中的相对丰度明显高于其他池(图2c)。占比第三的细菌门类为疣微菌门,在各池之间的变化为2.52%~22.84%,该门在生物滤池中的相对丰度为22.84%,显著高于其他池的相对丰度(2.52%~13.57%)(图2d)。由门分类水平上的各池中细菌群落结构可以看出,生物滤池和海马齿浮床池中的细菌群落组成与其他池有较大差异,存在其特殊的细菌种群。

图2 各样品中的主要菌群相对丰度的差异Fig.2 The variation in relative abundance of the most dominant bacterial communities in different samplesEpiPro.珍珠龙胆石斑鱼池;LutPro.红鳍笛鲷池;Sed.沉淀池;Ozo.蛋白分离池;Bio.生物滤池;Pla.海马齿浮床池;下同.EpiPro.E. fuscoguttatus ♂×E. lanceolatu ♀ tank;LutPro.L. erythropterus tank;Sed.Sedimentation filter tank;Ozo.Protein skimmer tank;Bio.Biofilter tank;Pla.S. portulacastrum floating bed tank;et sequentia.
进一步对该循环水养殖系统中的优势菌属进行统计分析。在所有样品中,交替赤杆菌属(Altererythrobacter)(1.96%~38.64%)、Loktanella(6.62%~20.36%)、Rubritalea(2.38%~22.72%)、NS3a_ marine_ group(0.91%~7.24%)、假单胞菌属(Pseudomonas)(0.25%~17.68%)、假交替单胞菌属(Pseudoalteromonas)(1.10%~7.63%)、发光杆菌属(Photobacterium)(0.58%~8.61%)7个属为优势菌属。对比水处理池和养殖池的优势菌发现,Loktanella在沉淀池和蛋白分离池中的占比(20.36%,18.20%)是其他池的2~3倍(6.62%~11.10%),Rubritalea在生物滤池中的占比(22.72%)明显高于其他池(2.38%~11.43%)(图3)。

图3 属水平的菌群相对丰度Fig.3 Relative abundance of genus-level bacterial communities
选取丰度占前30的菌群构建属水平物种丰度聚类热图,比较样品之间群落组成的相似性和差异性。结果显示,沉淀池和蛋白分离池聚为一支且支长最短,生物滤池和海马齿浮床池聚为一支,表明沉淀池和蛋白分离池的菌群相似度高,其次生物滤池和海马齿浮床池菌群组成较相似(图4)。

图4 核心微生物属水平的物种丰度聚类Fig.4 Heatmap of core microbiome at genus level
2.4 循环水养殖系统各单元微生物多样性分析
各样品的运算分类单元覆盖率均在99.7%以上,说明本次测序较好地代表了样品中菌群的真实情况。α多样性可以反映单个样品菌群丰度和菌群多样性。由Ace和Chaol指数可以看出,海马齿浮床池菌群丰度最高,生物滤池的菌群丰度最低。海马齿浮床池香农指数最大,辛普森指数最低,表明其菌群多样性最高,生物滤池菌群多样性较低。另外沉淀池和蛋白分离池的菌群丰度和菌群多样性差别不大。珍珠龙胆石斑鱼池和红鳍笛鲷池菌群丰度相似,但红鳍笛鲷池菌群多样性在所有样品中最低(表2)。

表2 各样品的α多样性指数Tab.2 α-diversity indices of each sample
2.5 循环水养殖系统各单元微生物群落功能分析
KEGG二级代谢途径所有样品共注释到44种功能中,除去相对丰度小于1%的代谢途径,做代谢途径比较图,结果显示,6个样品中基因相对丰度较高的功能包括氨基酸代谢、碳水化合物代谢、能量代谢、全局和概述地图、辅助因子和维生素代谢、核苷酸代谢、外来物质的降解和代谢(图5)。总体而言,该循环水系统中细菌群落占优势的功能类群主要在新陈代谢方面。

图5 不同样品相对丰度大于1%的KEGG代谢途径(二级功能层)Fig.5 KEGG pathway of relative abundance exceeding 1% of samples in different samples (hierarchy level 2)A.氨基酸代谢;B.其他次生代谢产物的生物合成;C.碳水化合物代谢;D.细胞运动;E.能量代谢;F.折叠、分拣和降解;G.全局和概述地图;H.糖链的生物合成和代谢;I.类脂化合物的代谢;J.膜转运;K.辅助因子和维生素代谢;L.其他氨基酸代谢;M.萜类和酮类化合物的代谢;N.核苷酸代谢;O.复制与修复;P.信号转导;Q.翻译;R.外来物质的降解和代谢;下同.A.amino acid metabolism;B.biosynthesis of other secondary metabolites;C.carbohydrate metabolism;D.cell motility;E.energy metabolism;F.folding,sorting and degradation;G.global and overview map;H.glycan biosynthesis and metabolism;I.lipid metabolism;J.membrane transport;K.metabolism of cofactors and vitamins;L.metabolism of other amino acids;M.metabolism of terpenoids and polyketides;N.nucleotide metabolism;O.replication and repair;P.signal transduction;Q.translation;R.xenobiotics biodegradation and metabolism;et sequentia.
为比较不同样品在代谢上的差异,将KEGG第二层级代谢途径的丰度相似性进行聚类。结果显示,生物滤池和海马齿浮床池聚为一支,沉淀池和蛋白分离池聚为一支,红鳍笛鲷单独为一支,这与核心微生物属水平的物种丰度聚类结果类似(图6),表明沉淀池和蛋白分离池以及生物滤池和海马齿浮床池的细菌群落行使的功能相似。

图6 不同样品KEGG代谢途径聚类Fig.6 Heatmap of KEGG pathway in different samples
比较循环水系统不同组分中氮循环基因功能的差异,由KEGG第三层级代谢途径下的氮代谢在各样品中的相对丰度可以看出,海马齿浮床池氮代谢的比例明显高于其他池(图7)。

图7 基于PICRUSt预测的不同样品中氮代谢相关基因相对丰度Fig.7 Relative abundances of genes relevant with N metabolism based on PICRUSt prediction in different samples
3 讨 论
在广西地区建立了一套适合南方养殖品种的工厂化循环水系统,通过高通量测序技术分析了该系统中各水处理单元以及养殖池中水体菌群群落组成和功能差异,可为循环水养殖提供理论基础。
3.1 循环水养殖系统各单元微生物群落分析
变形菌门是海洋环境中的主要异养菌,其中占主导地位的是α-变形菌纲和γ-变形菌纲[6,13]。拟杆菌门是海洋环境重要的微生物类群,是溶解性有机物的主要消费者[14],能降解养殖系统中的溶解性有机物,起到净化水质的作用。这两种是大多数海水循环水养殖系统中最主要的细菌门类。Martins等[15]研究了大菱鲆(Scophthalmusmaximus)和赛纳加尔鳎(Soleasenegalensis)循环水养殖系统中各水处理单元的菌群组成,发现变形菌门是其中最优势菌群,其次为拟杆菌门。吴越等[16]发现,变形菌门是石斑鱼循环水养殖系统中最丰富的微生物群落。本研究结果显示,在门分类水平上,该系统中的优势菌群为变形菌门、拟杆菌门,其次为疣微菌门。比较循环水系统各单元之间细菌群落的变化发现:α-变形菌纲在生物滤池和海马齿浮床池中显著减少,拟杆菌门在生物滤池和海马齿浮床池中的相对丰度明显升高,疣微菌门在生物滤池中的相对丰度为22.84%,显著高于其他池的相对丰度(2.52%~13.57%)。疣微菌门细菌是水生和陆地生态系统中数量最多和最关键的门类之一[17],但由于疣微菌门的细菌多为不可培养的微生物,其功能还鲜为人知。有研究表明,环境中氮、磷含量会影响疣微菌门的群落组成和相对丰度[18-20]。侯婷婷等[21]发现,工厂化循环水养殖青石斑鱼(E.awoara)系统中疣微菌门的平均相对丰度较高,认为是循环水养殖系统正向选择的结果。由门分类水平上的各池中细菌群落结构可以看出,生物滤池和海马齿浮床池中的细菌群落组成与其他池有较大差异,拟杆菌门和疣微菌门相对丰度均较高。进一步从属水平分析,该循环水系统所有样品中的优势菌属为交替赤杆菌属、Loktanella、Rubritalea、NS3a_ marine_ group、假单胞菌属和假交替单胞菌属和发光杆菌属。交替赤杆菌属对水体中的污染物多环芳烃的降解发挥着重要的作用[22]。Loktanella属红杆菌科,在海水生态系统中广泛存在,其在生态系统中的作用还未可知,但红细杆菌科细菌已被鉴定为对含氮污染物的去除具有主要作用的菌群[23]。Rubritalea能将硝态氮还原成亚硝态氮,氧化多种有机分子进行生长[24]。已知的许多假单胞菌属细菌同时兼具异养硝化和好氧反硝化双重功能[25],并参与磷的转化和循环[26],有较强的脱氮除磷能力。假交替单胞菌属能分泌抗细菌、抗真菌、抗病毒、杀藻、溶琼脂和细胞毒素等生物活性物质[27],在水产上能起到防治病害和赤潮等作用。以上结果说明各池的优势菌群在整个系统中能起到积极的作用。
3.2 循环水养殖系统微生物多样性分析
微生物多样性结果显示,珍珠龙胆石斑鱼池和红鳍笛鲷池菌群丰度相似,但红鳍笛鲷池菌群多样性在所有样品中最低,这可能与养殖品种的不同有关。另外,沉淀池和蛋白分离池的菌群丰度和菌群多样性差别都不大。生物滤池对降解整个循环水养殖系统中无机氮起着重要的作用[28]。有研究显示,生物滤池微生物含量会通过生物滤膜表层细菌的脱落进入水体而增加[29]。吴越等[16]在研究石斑鱼循环水养殖系统时发现,生物滤池中微生物数量较多,多样性较为丰富。在本研究中表现出不同的结果,从运算分类单元数目和α多样性指数分析可见,生物滤池中菌群丰度最低,菌群多样性也较低。但养殖水经过生物滤池后,水净化效果显著,这可能是因为虽然生物滤池的菌群丰度和多样性不高,但参与氮、磷代谢的功能菌较多,或是生物填料里生物膜上菌群很丰富,因此水处理效果明显。另外海马齿浮床池菌群丰度和菌群多样性均最高,这是因为植物根际能分泌根际微生物所需的碳源和其他营养物质,从而影响根际微生物的群落结构[30]。
3.3 循环水养殖系统各单元微生物群落功能分析
海洋环境中营养物质的含有量与微生物群落结构和功能密切相关[31],水体营养水平的变化不仅能改变微生物的丰度和多样性[32],还能显著影响微生物群落功能[33]。循环水各单元微生物群落基因功能共注释到44种功能,结果显示,该循环水系统中细菌群落占优势的功能类群主要在氨基酸代谢、碳水化合物代谢、能量代谢、辅助因子和维生素代谢、核苷酸代谢等方面。KEGG第二层级代谢途径的功能聚类热图结果与核心微生物属水平物种丰度聚类热图结果类似,沉淀池和蛋白分离池聚为一支且支长最短,生物滤池和海马齿浮床池聚为一支,表明相似的细菌群落结构行使的功能也类似。循环水养殖模式属于高密度集约化养殖,其养殖过程中由残饵、粪便产生的氨氮、亚硝态氮是整个系统中主要的代谢废物,也是重点去除对象。沉淀池主要用于大颗粒悬浮物沉降,该系统中沉淀池面积约占15%,养殖水经过沉淀池后,由于大颗粒悬浮物清除作用,化学需氧量、氨氮、亚硝态氮、硝态氮和磷酸盐的质量浓度大幅下降。但经过蛋白质分离池后,各水质指标又略微升高。再经过生物滤池的净化处理,各水质指标均有不同程度的下降,尤其是硝态氮、亚硝态氮和磷酸盐质量浓度下降明显,去除率分别为36.78%、22.09%和36.78%,最后经过海马齿浮床池后,亚硝态氮质量浓度又下降了34.37%,说明该系统中生物滤池和海马齿浮床池菌群有较好的水处理效果,海马齿浮床池中氮代谢相关功能基因相对丰度明显高于其他样品也证实了这一点。根际微生物在植物对污染物的吸附和积累以及污染物的降解和转化中起着关键作用[34]。海马齿在水体富营养化治理和生物修复中取得了良好的效果,如在湛江地区用海马齿浮床在对虾精养池塘中吸收养殖水体中富含的氨氮、亚硝态氮、磷酸盐等营养盐[35];通过构建室内模拟海水养殖系统海马齿生物浮床发现,系统中氮、磷去除能力有显著提高[36]。由于生物浮床系统具有成本小、耗能低以及无二次污染等特点,因此海马齿浮床可在海水循环水养殖中广泛应用。
4 结 论
综上所述,生物滤池和海马齿浮床池中α-变形菌纲相对丰度显著减少,拟杆菌门明显增多,同时疣微菌门在生物滤池中的相对丰度显著高于其他池。从属的水平分析,优势菌Loktanella在沉淀池和蛋白分离池中的占比是其他池的2~3倍,Rubritalea在生物滤池中的占比明显高于其他池。海马齿浮床池菌群丰度和菌群多样性均最高,生物滤池菌群丰度最低。在群落组成和结构方面,生物滤池和海马齿浮床池样品与其他样品相似度最低。
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼第一线"微信公众帐号和微信视频号"养鱼第一线刘文俊视频号"以及头条号"水花鱼@渔人刘文俊"!


