论文:固定化培养对小球藻生长、光合色素含量和叶绿素荧光参数的影响

固定化培养对小球藻生长、光合色素含量和叶绿素荧光参数的影响
王祎哲, 韩朝婕,卜世勋,韩 旭,周文礼,贾旭颖
(天津农学院水产学院,天津市水产生态及养殖重点实验室,天津 300384)
引 言
小球藻属(Chlorella)微藻作为目前微藻中应用开发较多的种类,不仅具有较高的生长速度,还蕴含丰富营养价值,如蛋白质、碳水化合物、维生素、矿物质和类胡萝卜素等[10],细胞中所含有的类胡萝卜素可作为抗氧化剂[11],在增强免疫系统[12],预防心血管疾病[13]、白内障[14]等方面具有巨大的潜力。因其丰富的营养成分和医疗保健作用,小球藻被认定为是一种及其重要的微藻资源[15]。除此之外,在鱼类育苗、养殖生产中,小球藻作为水体中重要的生物组分部分,既可以在工厂化人工育苗技术中作为最常用的基础生物饵料[16-18],又可以吸收水体中的氨氮等其他有害物质[19]。
贲月等[20]的研究表明:选取海藻酸钠对铜绿微囊藻有显著的固定效果,对藻类的生长有促进效果。具备较好的传质能、机械强度、避免生物分解的能力,且对生物无害的优点,是较好的固定化细胞的材料。本文选取海藻酸钠作为固定化载体,研究固定化与液体悬浮态两种培养方式小球藻对生长、光合色素含量及叶绿素荧光参数的影响,以期为此后的微藻培养技术找到一种高效、便捷的方法。
1 材料与方法
1.1 微藻及培养
小球藻由天津市水产生态及养殖重点实验室提供,基础培养基为海水配制的经120℃ 条件下灭菌20 min的f/2培养基。取对数生长期生长良好的小球藻按照藻液∶培养基=1∶1的比例在超净工作台内接种,在恒定培养箱内进行静置培养,设定培养箱温度为25 ℃,光照强度为50 μmol/(m2·s),光照周期为12 L∶12 D,每天定时至少摇动3次藻液防止贴壁或沉淀。
1.2 试验方法
1.2.1 小球藻的固定化培养
将培养在f/2培养基中的生长状况良好的小球藻,5000 r/min离心10 min,把上清液弃除后,将小球藻混合于4% 的海藻酸钠溶液中,搅拌均匀后,利用10 mL注射器在距离预冷后的CaCl2溶液水面20 cm处滴入,形成小球状,静置1 h后,灭菌蒸馏水洗涤多次备用,放入配制好的f/2培养基中于培养箱中静置培养,培养条件同1.1。
1.2.2 小球藻胶球解固定
从培养液中取出一定数量的胶体小球,滴加一定量的3%的柠檬酸钠溶液,静置至胶球完全溶解。
1.3 测定方法
1.3.1 细胞密度测定
采用血球计数板法对藻细胞密度进行测定。
1.3.2 色素含量测定
参考乙醇法对藻类进行叶绿素a、叶绿素b、类胡萝卜素含量测定。
取样品5 mL经5000 r/min离心10 min去掉上清液,加入5 mL 95%乙醇溶液后于4℃冷藏24 h后,经5000 r/min离心10 min取上清,测定各波长下吸光值。
Ca(mg/L)=13.95A665-6.88A649
(1)
Cb(mg/L)=24.96A649-7.32A665
(2)
Cc(mg/L)=(1000A470-2.05Ca-114.8Cb)/245
(3)
式中:Ca、Cb分别为叶绿素a和b的浓度;Cc为类胡萝卜素的总浓度;A665、A649和A470分别为叶绿体色素提取液在波长665 nm、649 nm和470 nm下的吸光度。
1.3.3 叶绿素荧光参数的测定
利用叶绿素荧光仪对叶绿素荧光各个参数进行测定。测定前,将1 cm样品放置于比色皿中暗适应15 min,启动叶绿素荧光仪测定初始荧光产量(F0),饱和脉冲后再测定小球藻的最大荧光产量(Fm),以此计算出最大光能转化效率(Fv/Fm,Fv为可变荧光产量)。测定的叶绿素荧光参数有F0、Fm、F0'、Fm'、Fs等,并根据荧光仪所提供的公式,计算出最大光能转化效率(Fv/Fm)、实际光能转化效率(ΦPSⅡ)和量子效率(yield)的荧光参数。具体公式如下:
最大光能转化效率Fv/Fm=( Fm-F0)/Fm
(4)
实际光能转化效率ΦPSⅡ=( Fm'-Fs ) /Fm'
(5)
量子效率yield= Fv'/Fm'=( Fm'-F0' ) /Fm'
(6)
1.4 数据分析
所有结果用“均值±标准差(mean±S.D.)”表示,使用SPSS19.0进行单因素方差分析(One-way test)、T检验(T-test)和Duncan多重比较分析,并用Sigma Plot14.0软件作图。
2 结果与分析
2.1 固定化培养对小球藻细胞密度的影响
固定化培养对小球藻细胞密度的影响如图1所示,试验期间,随着培养时间的延长,两种培养方式小球藻细胞密度均显著升高(P<0.05)。试验初期(2—4 d)固定化培养小球藻细胞密度高于液体悬浮态小球藻,但二者之间差异不显著(P>0.05),试验中后期(6—10 d),固定化培养小球藻细胞密度增长明显,试验结束时其细胞密度达到2.641×106cells/mL,是悬浮态的1.27倍,显著高于悬浮态小球藻细胞密度(P<0.05)。
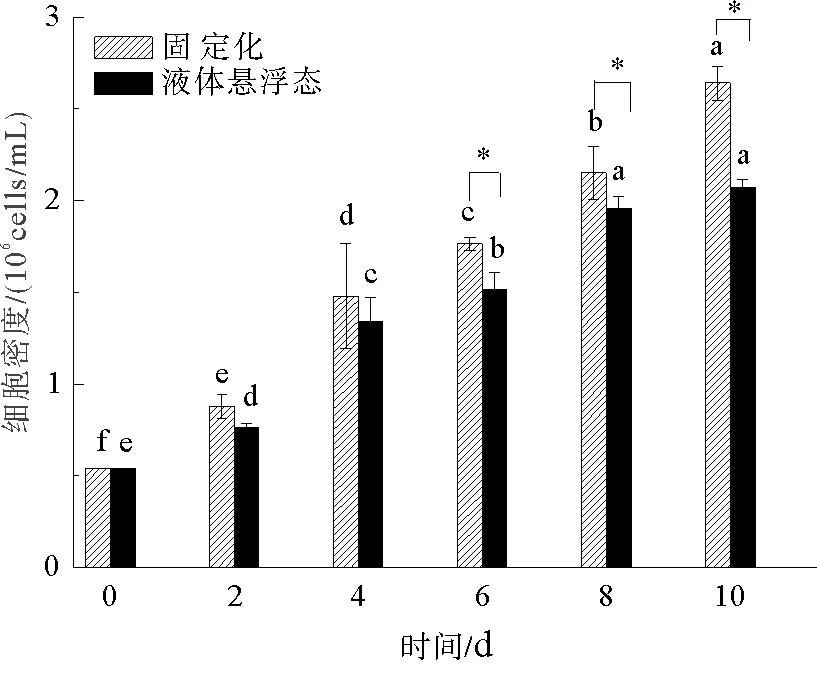
图1 固定化培养对小球藻藻细胞密度的影响
2.2 固定化培养对小球藻光合色素含量的影响
固定化培养对小球藻光合色素含量的影响如图2所示,试验第2天,两种培养方式小球藻之间的叶绿素a、叶绿素b和类胡萝卜素含量均无显著差异(P>0.05),从第4天开始固定化培养小球藻三种光合色素含量均出现大幅度增长,在试验的 4—10 d,固定化培养小球藻三种光合色素含量均显著高于液体悬浮态小球藻(P<0.05)。试验结束时,固定化培养小球藻叶绿素a、叶绿素b和类胡萝卜素含量分别达到液体悬浮态小球藻的3.79倍3.54倍和3.01倍。在试验期间,随着培养时间的延长,固定化培养小球藻三种色素含量始终处于上升趋势,而液体悬浮态小球藻各色素含量均在第8天达到峰值,而在第10天开始出现下降。
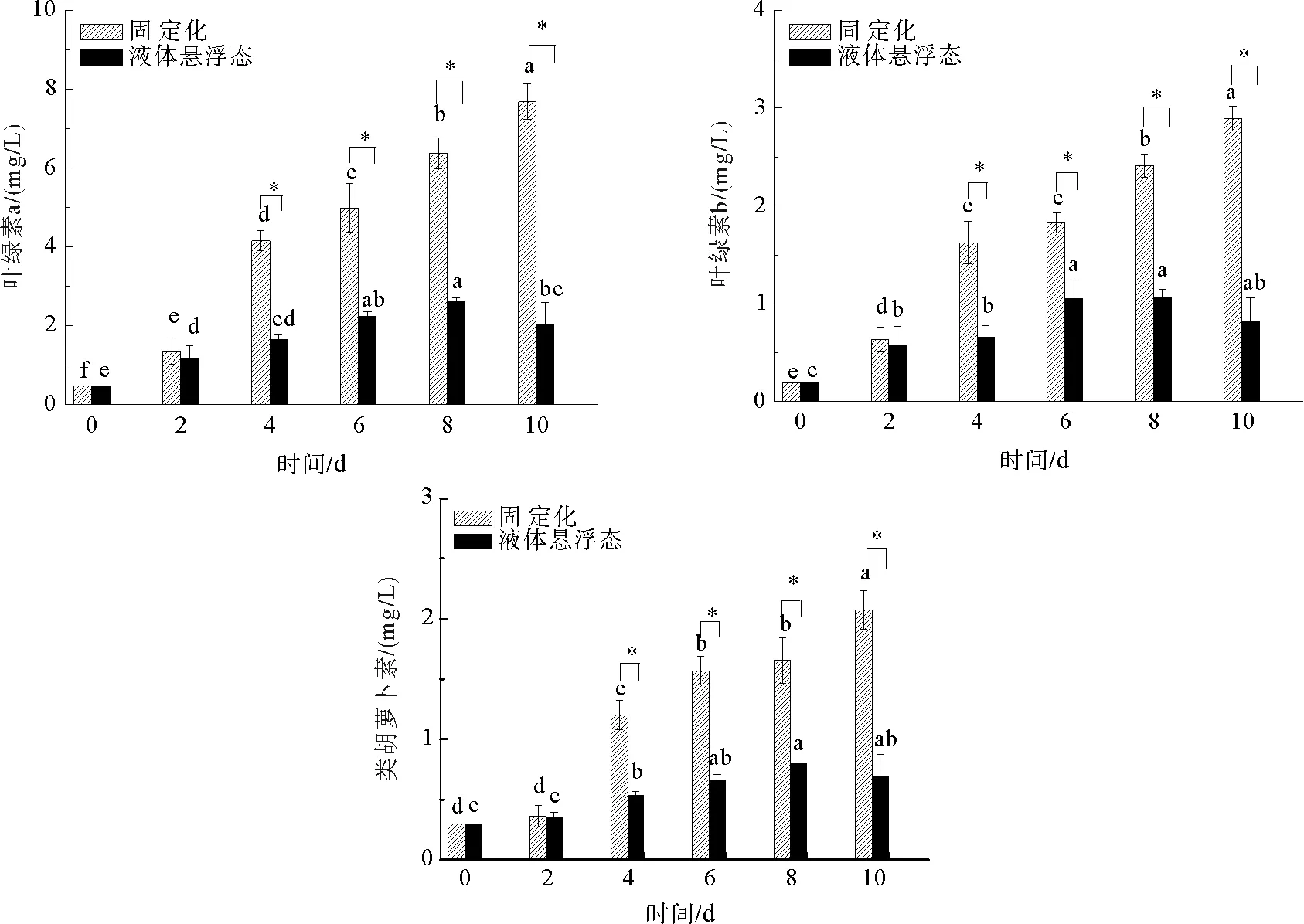
图2 固定化培养对小球藻光合色素含量的影响
2.3 固定化培养对小球藻叶绿素荧光参数的影响
由图3可见,试验开始后,固定化培养和悬浮态培养小球藻的Fv/Fm均显著升高,在试验的2—10 d,悬浮态小球藻Fv/Fm基本稳定,而固定化培养小球藻Fv/Fm在试验2 d后仍持续升高,在4—10 d保持稳定。试验初期(第2天),固定化小球藻的Fv/Fm显著低于液体悬浮态小球藻,而在试验后的4—10 d,固定化小球藻的Fv/Fm则显著高于悬浮态培养小球藻(P<0.05)。试验开始后,两种培养方式小球藻ΦPSⅡ均呈上升趋势,但是在2—8 d,液体悬浮态小球的ΦPSⅡ升高趋势不显著(P>0.05),而固定化小球藻在试验的4—10 d显著升高,呈显著的上升趋势(P<0.05)。试验的2—4 d两种培养模式小球藻ΦPSⅡ 无显著性差异(P>0.05),从试验第6天起固定化培养小球藻实际光能转化效率显著始终高于悬浮态(P<0.05)。试验初期,固定化与液体悬浮态小球藻的量子效率在显著升高,但固定化培养小球藻量子效率的升高幅度远大于液体悬浮态小球藻,试验4—10 d,固定化培养小球藻量子效率显著高于液体悬浮态小球藻(P<0.05)。
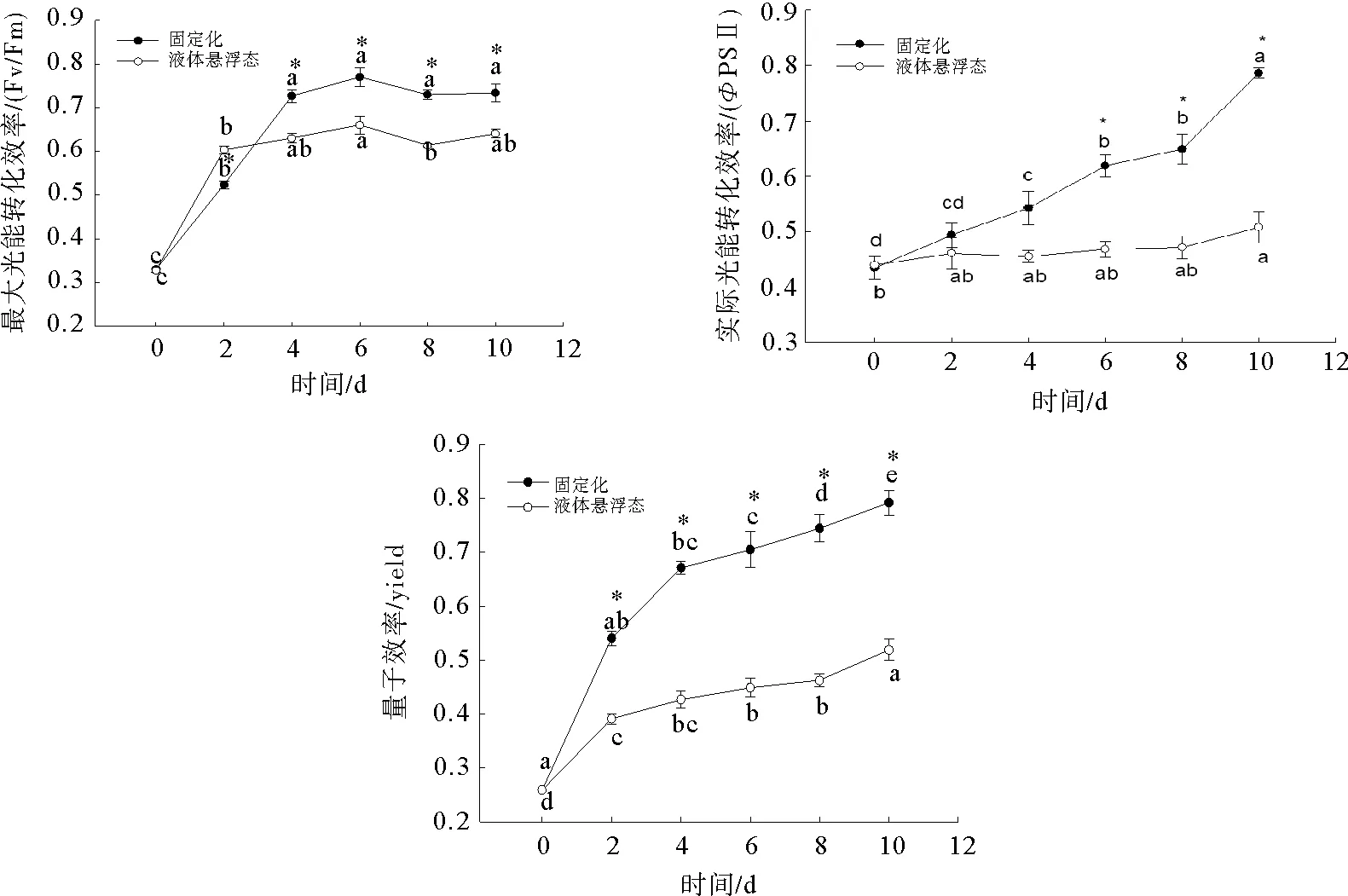
图3 固定化培养对小球藻叶绿素荧光参数的影响
3 讨论
3.1 固定化培养对小球藻细胞密度的影响
细胞密度可以直观地反映藻类的生长情况,固定化培养使小球藻的生存环境和自身的适应能力均发生了不同程度的改变[8]。本试验结果表明,固定化细胞在培养前期生长速率较慢,随后开始迅速生长,最终生物量显著高于液体悬浮态,可见,固定化培养更有利于纤细裸藻的生长,但固定化培养初期细胞生长较为缓慢,主要是由于固定化胶球制作这一系列过程对细胞生长环境有一定程度的改变,以及试验初期营养物质和光线进入胶珠受到一定水平的影响,因此妨碍其生长的缘故[8],可见,试验初期藻细胞需要一定时间来适应生长环境的改变。试验后期,固定化培养表现出良好的生长趋势,说明固定化小球藻的生长情况优于液体悬浮态,已有研究证明,通过对藻的数量、形态以及对燃料降解能力比较的研究,经优化固定条件后培养的蛋白核小球藻(Chlorellapyrenoidosa)以上指标均优于液体悬浮态,证明固定化后培养提高了藻的生长状态与合成代谢活性[21]。固定化小球藻的生长性能有所提高,可能是固定化培养条件不仅提高了小球藻藻细胞的合成代谢,并且在一定程度上降低了藻细胞的分解代谢,能较长时间的保持藻细胞的活性,延迟藻细胞的衰老[22]。
3.2 固定化培养对小球藻光合色素含量的影响
藻类进行光合作用时是由色素蛋白复合体进行光能捕获完成的,藻体内常见的色素可依据在光合作用过程中的作用分为捕光色素和光保护色素,其中以叶绿素a、叶绿素b为代表的捕光色素可将吸收的光能有效地传递到相关的反应中心转变为化学能,而类胡萝卜素作为光保护色素将剩余能量吸收,避免膜体受伤,从而达到光保护作用[23]。藻体内光合色素的含量和光合作用有密切的关系,因此,可通过光合色素含量的多少来判断藻类的生理状态[24]。
固定化培养对小球藻的叶绿素a、b、类胡萝卜素含量都有一定程度上的增加,第4天起,固定化培养各色素含量均高于液体悬浮态培养。由此发现,固定化培养对小球藻的光合色素含量的增加具有促进作用,且液体悬浮态第10天时各色素出现下降,分析原因可能是培养液中的营养物质不足以满足藻细胞新陈代谢的需要,生长缓慢,叶绿素的合成减少,含量出现下降[25],而固定化培养延缓了小球藻色素含量下降的时间,因此,固定化培养的小球藻在色素含量以及色素增长时间两方面均要优于液体悬浮态小球藻。Bailliez[26]等人也报道了固定化培养后的布朗葡萄藻(Botryococcusbraunii)叶绿素含量较高,推测是因固定化后藻细胞光合作用增强,且物质能量消耗也有所降低所致,也就是固定化培养的小球藻能量的合成大于消耗,从而能量得以高效积累[27]。对于固定化培养后的铜绿微囊藻(Nannochloropsisoculata)也得出同样的结论,固定化藻细胞的合成代谢能力得到了提高[28],同时也说明了固定化藻类在色素积累方面确实要优于液体悬浮态微藻;富烃葡萄藻(Botryococcusprotuberans)经藻酸盐包埋后,在稳定期产生的叶绿素、类胡萝卜素及其干质量以及光合效率与游离细胞相比都有明显增加[29]。以上与本试验固定化培养对小球藻生长情况及色素含量具有优势影响相一致,固定化培养提高了小球藻的合成代谢,光合色素含量增加,且色素下降时间得到了延缓。
3.3 固定化培养对小球藻叶绿素荧光参数的影响
叶绿素荧光作为光合作用的有效探针,能够客观地反映植物光合能力的强弱和光合器官PSⅡ活性[30]。本试验结果表明,仅在培养的前2天,固定化小球藻的Fv/Fm低于液体悬浮态小球藻,而在培养的中后期,其结果与前期恰好相反,固定化小球藻的Fv/Fm值更高。Fv/Fm反映了光反应中心PSⅡ的最大量子产量[31],此值明显变低说明植物正处于环境胁迫中[32],说明试验初期固定化藻细胞处于环境胁迫中,光合活性受到抑制[33],但在试验后期,固定化小球藻始终处于生长阶段,且通过Fv/Fm升高体现出固定化小球藻有较好的生长状态与光合活性。
本研究表明,固定化培养对小球藻叶绿素荧光参数有显著影响。在固定化与液体悬浮态这两种方式培养中,固定化培养的小球藻ΦPSⅡ、yield参数均有明显上升趋势。即固定化培养的光合特性和生长情况均优于液体悬浮态,更适宜小球藻生长,提高其光合效率,这与对小球藻(ChlorellasorokinianaGXNN 01)固定化后,其生物量、生长率和光合活性等方面都略优游离态小球藻这一结果相似[34],虽由于上述所提及到的小球藻因改变自身状态会出现生长缓慢期,但从整体来看,固定化培养的小球藻生长状态、光合特性均优于液态悬浮状态的小球藻。这也说明固定化培养小球藻较比液体悬浮状态小球藻有促进其生长的作用。
4 结论
综上所述,固定化培养对小球藻生长及生理特性产生了显著的影响,小球藻固定化培养在细胞密度、光合色素含量及光合活性方面均优于液体悬浮态培养。
声明:本站未注明出处的转载文章是出于传递更多信息之目的。若有未注明出处或标注错误或侵犯了您的合法权益,请与本网站联系,我们将及时更正、删除,谢谢!


欢迎关注本站"养鱼第一线"微信公众帐号和头条号!将会定期向你推送本号信息!将为你精诚服务!


