通讯:13983250545
微信:ycsh638
QQ:469764481邮箱:ycsh6318@163.com
论文:牡蛎中诺如病毒的感染及其防控研究进展

牡蛎中诺如病毒的感染及其防控研究进展
赵 峰,佟利惠,杨 敏,王珊珊,刘 楠,孙 永,周德庆
(1. 中国水产科学研究院黄海水产研究所/青岛海洋科学与技术试点国家实验室海洋药物与生物制品功能实验室,山东青岛 266071; 2. 上海海洋大学食品学院,上海 201306; 3. 重庆三峡学院生物与食品工程学院,重庆 404100)
诺如病毒 (Norovirus, NoV) 是世界范围内引起非细菌性急性胃肠炎的主要病原体,常通过被污染的环境、水源及水产品如牡蛎等引起急性胃肠炎疫情暴发[1]。诺如病毒分为7个基因簇 (GI— GVII),其中GI、GII和GIV可感染人类,是引发人类疾病的主要类型,以GI、GII最为常见,并可进一步分为9个和22个基因型,而GIV型较少被检出[1-3]。NoV具有极强的传染性,仅10个病毒颗粒即可使人致病,被感染者会出现持续3 d左右的腹泻或呕吐,儿童、老年人和有基础疾病的人群病情可加重[4-5]。流行病学调查结果显示,全球范围内约1/5的急性胃肠炎暴发由NoV引起,冬、春季是NoV疫情的高发期,近年NoV在中国、美国、日本、西欧等均出现大规模暴发[6-10]。感染者出现感染症状的概率随NoV摄入剂量的增加而增大。海产贝类因其底栖和滤食性特性,可从海洋环境中富集NoV。素有“海洋牛奶”之称的牡蛎是我国沿海地区重要的经济贝类,也是NoV的重要传播媒介之一。虽然彻底加热处理可有效灭活牡蛎中的NoV,但为了保持其鲜美风味,人们倾向于生食或轻微烹煮,若食用的牡蛎存在NoV污染,便会增加感染NoV的风险。
对食品中NoV的检测主要采用反转录实时荧光定量聚合酶链式反应 (Reverse transcription-quantitative real-time polymerase chain reaction, RT-qPCR),但此方法不能区分NoV是否具有活性或感染性。近年来国内外研究发现猪胃黏蛋白偶联磁珠 (Porcine gastric mucin-conjugated magnetic beads, PGM-MB)、核酸嵌入剂 [叠氮溴化丙锭 (Propidium monoazide, PMA) 和叠氮溴化乙锭 (Ethidium monoazide,EMA] 等结合RT-qPCR方法检测感染性NoV有效果[11-15]。超高压 (High hydrostatic pressure, HHP) 处理作为一种非热加工技术,主要用于生产高端生食产品,应用于牡蛎不仅可杀灭有害病原体、延长贮藏期,还可用于脱壳。本文综述了牡蛎中NoV的污染状况、富集机制、检测方法以及HHP处理技术对NoV消减控制方面的研究进展,旨在为牡蛎产业的发展与食用安全提供参考。
1 牡蛎中 NoV 的污染与富集机制
1.1 NoV对牡蛎的污染状况
许多由NoV引起的食源性急性胃肠炎暴发均与食用牡蛎有关。据统计,与牡蛎相关的食源性疾病中,约一半由NoV引起[16]。牡蛎是滤食性双壳类,每小时可过滤约20 L海水,在过滤海水时环境中的NoV可进入牡蛎体内并富集[17],牡蛎体内的病毒浓度比周围环境高几十甚至几千倍[3,18-19]。且牡蛎的栖息地主要在沿海河口,营固着生活,NoV可以通过多种方式进入牡蛎生产区,如城市排污管、污水处理厂未处理彻底的污水、进入生产区的感染NoV的人等[20]。生长水域被NoV污染后,牡蛎会通过自身的滤食作用从污染的水中富集NoV,并在消化道等部位积累;NoV一旦进入体内,牡蛎很难通过自身代谢或净化作用将其排出体外[21]。
每年11月至翌年3月是牡蛎消费旺季,也是因食用受NoV污染的牡蛎而染病的高风险季节。寇晓霞等[22]应用RT-qPCR方法对广东省地区市售牡蛎中NoV的污染状况进行调查与分型鉴定,发现牡蛎样品的NoV总检出率为17.20% (50/290),不同季节的NoV污染率分别为春季12.50%、夏季6.90%、秋季18.30%和冬季30.70%,冬季显著高于其他季节,NoV的基因型以GII型 (11%) 为主。吕素玲等[23]对广西养殖牡蛎中NoV的污染状况进行调查,发现牡蛎样品中NoV总检出率为11.04% (53/480),其基因型为GII型。马丽萍[24]对黄渤海区沿海城市牡蛎中NoV污染状况调查发现,NoV检出率可达19.35%。Liu等[16]对山东省沿海地区牡蛎养殖区进行了为期1年的监测,发现NoV检出率为16.9% (60/356);60份阳性样本中,43.3%(26/60) 为 GI型,31.7% (19/60) 为 GII型,25.0% (15/60) 同时检出GI和GII;阳性样本大多为冬季样本,占65.0%(39/60)。上述研究表明,我国牡蛎中NoV的污染水平相对较高,冬季NoV的污染水平显著高于其他季节,应加强防控。
1.2 牡蛎与NoV结合机制
组织血型抗原 (Histo-blood group antigens, HBGAs) 为人类结合NoV的受体,是一类具有高度多态性的糖类抗原,在肠道上皮细胞上表现为ABO型、分泌型和Lewis型。研究表明,牡蛎体内也存在类似的HBGAs,被认为是NoV同牡蛎相结合的受体,NoV通过与牡蛎组织中的类HBGAs特异结合,使得NoV难以排出体外[25]。Le Guyader等[26-27]对太平洋牡蛎 (Crassostrea gigas) 组织中的类 HBGAs 与 NoV 病毒样颗粒 (Virus-like particles, VLPs)特异结合的研究表明,GI.1型VLPs只与太平洋牡蛎的消化腺结合,而GII.3、GII.4型VLPs可与太平洋牡蛎的所有组织结合。此外,环境因素如溶解氧、pH、温度和盐度均会对牡蛎类HBGAs的表达产生影响,高溶氧量、高pH、低温和高盐利于牡蛎中类A型HBGAs的表达[28-29],在此条件下NoV更易在牡蛎体内积累[30]。但牡蛎中类HBGAs的产生以及调控NoV积累的机制还有待进一步研究。
2 牡蛎中 NoV 的检测方法
2.1 NoV定量检测方法
2013年国际标准化组织发布定性和定量检测各种食品(包括贝类) 中 NoV 的标准方法 (ISO/TS 15216-1和 ISO/TS 15216-2),中国于2016年也颁布了贝类中NoV的RT-qPCR检测方法标准。RT-qPCR具有灵敏度高、可定量检测等优点,在进行RT-qPCR前先要提取病毒RNA,由于NoVs在牡蛎中的含量较低且回收富集困难,因此寻找简便有效的牡蛎中NoVs RNA的提取方法对后续的检测尤为重要[31-32]。Zhang 等[32]以现行 ISO/TS 15216-2: 2013为基础,对4种从牡蛎消化组织中提取NoV的方法进行比较,结果发现蛋白酶K消化联合聚乙二醇沉淀法效果最好,该方法的回收率和扩增效率分别为 (11.07±0.09)%和 (124.12±5.99)%,是 ISO/TS 15216-2: 2013方法的 7倍。
牡蛎中含有的NoV颗粒较少,研究已证实少数 (仅10个) 具有感染活性的NoV颗粒即可引发人类急性胃肠炎,且在食品基质及环境中NoV基因组的稳定性也远高于其他具有相应感染活性的病毒[17]。目前,现有的有关NoV检测的国家、国际检测标准大多以RT-qPCR扩增结果为依据,但这种检测方法并不能辨别NoV的感染性 (RT-qPCR会同时扩增NoV中游离、部分降解或受损的以及受损衣壳中的RNA),导致感染性NoV的检出率偏高,因此感染性NoV的确证一直是检测技术的瓶颈。
NoV最早在电子显微镜下被观察到,电镜法可对粪便样本中的NoV颗粒进行观察检测。酶联免疫吸附 (Enzyme linked immunosorbent assay, ELISA) 也是一种检测 NoV 的方法,但其灵敏度不高,检测限为每克104~106且耗时较长,特别是在检测牡蛎中低含量水平的NoV时容易受到限制。
宏基因组测序可以检测和识别病毒基因组物质,现已广泛应用于食源性病毒的检测。Imamura等[33]对日本6个不同地点的牡蛎中感染性NoV进行了为期5个月的检测,通过测序对基因型进行了鉴定。Strubbia等[34]通过宏基因组学方法评估3种牡蛎类型中NoV的积累规律时发现宏基因组学方法在检测牡蛎样本中低浓度NoV时较为困难。由于NoV的基因型具有多样性,在牡蛎中的含量也较低,导致病毒宏基因组学在检测中的应用仍存在挑战,现广泛应用于NoV检测的方法是RT-qPCR[35]。
2.2 感染性NoV的检测方法
2.2.1 与 HBGAs 结合的检测方法 具感染性的 NoV 衣壳蛋白是完整的,可与HBGAs结合,故能通过检测衣壳与HBGAs的结合能力来评估NoV是否具有感染性。猪胃黏蛋白 (Porcine gastric mucin, PGM) 含有 A、H1和 Lewis b型HBGAs,NoV与PGM的相互作用可以抑制NoV与HBGAs的结合能力[36]。利用PGM与磁珠结合捕获NoV,再进行 RT-qPCR检测NoV,可有效检测牡蛎中的感染性NoV。已有大量报道应用PGM-RT-qPCR测定NoV在各种消减处理后的灭活情况,如热处理、含氯消毒剂等[37]。Leon等[38]对人工污染NoV的牡蛎样品进行HHP处理灭活NoV,结果发现400 MPa HHP处理后,NoV成活率降低至21%,在600 MPa下处理后能对NoV 完全灭活。Ye等[39]为了验证PGM-RT-qPCR检测方法的可行性,采用与Leon等[38]完全相同的实验条件处理牡蛎,并利用PGM-RT-qPCR进行测定,结果表明此方法对感染性NoV的检出率与Leon等[38]的结论有密切的相关性。使用PGM研究不同HHP处理条件对NoV灭活效果的大量实验证明,PGMRT-qPCR是一种可有效区分感染性NoV的检测方法。
2.2.2 与核酸嵌入剂结合的检测方法 核酸嵌入剂如EMA和PMA已被许多研究者作为区分感染性与非感染性NoV的方法[13-14]。PMA是一种高亲和力的光反应性核酸染料,不能进入衣壳蛋白完整的病毒,但能够穿透被破坏或损坏的衣壳,穿透后在强光照射下共价插入RNA,干扰RT-qPCR扩增[12]。Randazzo等[14]对不同核酸嵌入剂进行对比,结果表明PMAxx对感染性NoV的区分效果优于EMA,PMAxx处理后感染性NoV的减少量高于EMA 0.64 lg。PMA可与RT-qPCR检测方法结合,在RT-qPCR检测前对样品进行预处理,以区分感染性病毒。Kim和Ko[12]用PMAxx-RT-qPCR方法检测鉴别时发现PMAxx-RT-qPCR可以有效区分感染性NoV。PMAxx已在区分感染性NoVs方面应用广泛,未来的研究中可对PMAxx浓度、照射时间等处理条件进一步优化。
PGM-RT-qPCR与PMA-RT-qPCR已应用于HHP处理对NoV消减灭活效果评价的研究,研究显示经PGM或PMA处理后,500 MPa HHP对NoV灭活的减少量要比仅用qPCR多,GI.1型NoV减少3 lg,GII.4型可减少4 lg[40-41]。由于PMA与NoV核酸结合的效率取决于浓度、光活化及孵育时间等诸多因素,这些因素均会对PMA与NoV的结合效率产生影响。而PGM可以与NoV特异性结合,所以PGM在检测感染性NoV灵敏度方面优于PMA。PGM的成本与PMA相近,综合而言,PGM与免疫磁珠、qPCR结合在区分感染性NoV中具有较大的推广潜力。
3 牡蛎中 NoV 的防控措施
3.1 热加工方法
热处理是灭活牡蛎中NoV的有效方法之一,中国疾病预防控制中心指南显示,餐具表面NoV的消除需煮沸消毒30 min。将带壳牡蛎蒸煮3 min,消化道内部温度仅有63 ℃,不足以灭活NoV。将受NoV污染的牡蛎消化腺内部温度保持在90 ℃持续90 s,即可实现病毒灭活[42]。但过度加热会对牡蛎的风味和外观产生负面影响。
3.2 牡蛎收获后净化处理消减NoV
牡蛎在收获后,通常会在净化池中暂养2~3 d,使其通过自身作用排出有毒有害物质。此处理对牡蛎中细菌的消减效果较好,但对NoV的消减效果不显著[43]。由表1可知,净化对NoV消减效果不明显,延长净化时间可以在一定程度上消减NoV,但其效果仍难以达到NoV安全剂量水平。因此,为了保持牡蛎的新鲜美味且兼顾安全性,还需依赖HHP等非热现代食品加工技术的发展。

表1 净化对牡蛎中诺如病毒消除效果的影响Table 1 Effect of purification on elimination of NoV in oysters
3.3 HHP处理对牡蛎中NoV的消减控制效果
HHP、辐照、酸性电解水等方法常用于杀灭贝类中的有害病原体,这些非热处理方法能较好地保持牡蛎原有的营养、口感、风味、色泽以及新鲜度。在辐照过程中,射线穿透牡蛎,可直接或间接破坏NoV的核酸以及衣壳蛋白,从而杀死NoV。低剂量 (<10 kGy) 的辐射不会改变产品原有的感观性状,保证了其营养价值且无任何有害物质残留。酸性电解水的主要功能成分是次氯酸,次氯酸分子量小,可以扩散到细胞体内,使病毒衣壳蛋白氧化,从而灭活NoV[47]。辐照和电解水技术在牡蛎加工中虽有应用,但并不广泛。目前,牡蛎加工中应用最广泛的是HHP技术,可在消减牡蛎中有害病原体的同时实现脱壳。
3.3.1 HHP灭活 NoV 的原理及牡蛎品质的变化 HHP是食品工业广泛应用的一种控制食源性病原体的非热加工处理方法[48-49]。目前,HHP技术在牡蛎等双壳类的加工中主要用于脱壳,且剥离的贝肉完整,可以节省劳动力[50]。通常用于牡蛎等贝类加工的压力范围为200~600 MPa,应用HHP技术处理牡蛎时,压力迫使牡蛎组织中的水进入病毒,导致蛋白质三级和四级结构发生变化,使病毒衣壳蛋白变性,从而致使病毒生物活性和繁殖能力丧失,无法与宿主细胞表面受体结合[51-52]。使用HHP处理时,压力在整个牡蛎中传递均匀、瞬时,且过程中温度变化很小 (约为3 ℃每100 MPa),可以减少食品的形变和感官特性的改变[53]。
与热加工处理方法相比,HHP技术可以降低对食品造成的质量损失,保留大部分天然的色、味,维生素和挥发性化合物等对热敏感的营养物质可保持不变[54],且对产品的形状、大小没有要求[55]。研究表明HHP处理可能会对牡蛎的外观、颜色、气味和质地产生影响。目前,在牡蛎加工生产中,一般认为压力超过300 MPa会影响其理化品质,使其颜色变黄,这是由于HHP可以加剧脂肪的氧化,且氧化程度与压力处理水平呈正相关[56]。但总体来说利大于弊,原因为:1) 使用HHP对牡蛎进行开壳后,肉比较完整,这点要优于传统的人工开壳方式,手工开壳时牡蛎肉可能会被刀片切碎。2) HHP处理后,牡蛎肉的硬度和耐咀性略有增强。硬度是评价牡蛎新鲜度的一个重要指标,HHP处理后的牡蛎肉硬度轻微增强,优于未处理牡蛎。3) 在压力的作用下,牡蛎壳内的水被挤压到组织内部,使其多汁性和风味得到很好的保持[57]。
3.3.2 影响 HHP 灭活效果的因素 HHP 处理 NoV 时,有许多需要考虑的因素,虽然对消减效果具决定性作用的是施加的压力水平,但加压时间、加压初始温度及NoV所在基质等也会对消减效果产生相当大的影响。研究表明,延长加压时间确实会使NoV减少量增多,但随着时间的延长,病毒减少量差异变小[58]。牡蛎含有大量的蛋白质和脂肪,这些物质会在HHP处理过程中对NoV形成保护作用,降低HHP对NoV的消减效果;低pH也会抑制HHP对NoV的消减效果[59]。有研究认为温度对消减效果的影响较大,降低加压温度,如4 ℃或6 ℃下与20 ℃相比,前者NoV的减少量显著提高[39, 41]。
3.3.3 HHP 对 NoV 消减效果的研究 由于 HHP处理对贝类的感官特征和营养品质的影响很小,国内外研究者对应用HHP来消减牡蛎等贝类中的NoV产生了浓厚的兴趣。HHP对NoV研究的试验表明,需要400 MPa以及更高压力才能使牡蛎中的NoV大量灭活[41,60-62]。HHP对牡蛎中NoV消减效果的影响见表2。Leon等[38]对人类志愿者进行了双盲临床试验,以评估HHP灭活GI.1 NoV所需条件,将4 lg 基因拷贝数的GI.1 NoV注入牡蛎,结果显示只有600 MPa、6 ℃下NoV才完全灭活,受试者完全未出现感染情况。400 MPa、6 ℃处理下,受试者患病概率降低,可以推测此处理条件可以灭活大多数NoV。Ye等[39]于0 ℃、350和500 MPa下对牡蛎中的GI.1和GII.4 NoV进行处理,NoV基因拷贝数可减少4 lg。Takahashi等[62]对缓冲液、牡蛎匀浆、带壳牡蛎3种基质中的NoV进行HHP处理,结果表明HHP对这3种基质中的NoV均有消减效果,但在缓冲液、牡蛎匀浆、带壳牡蛎中的消减效果依次降低,表明HHP对NoV的消减效果与病毒所处的环境基质有关,牡蛎中的脂肪和蛋白质可以保护NoV不受HHP影响。此外,HHP处理过程中时间、pH、盐度等对病毒的灭活效果也有一定影响,在中性pH条件下,GI.1和GII.4 NoV 的减少量 (2.3 lg 和>3.8 lg) 高于 pH=4 (0.4 lg 和1.2 lg)[21]。
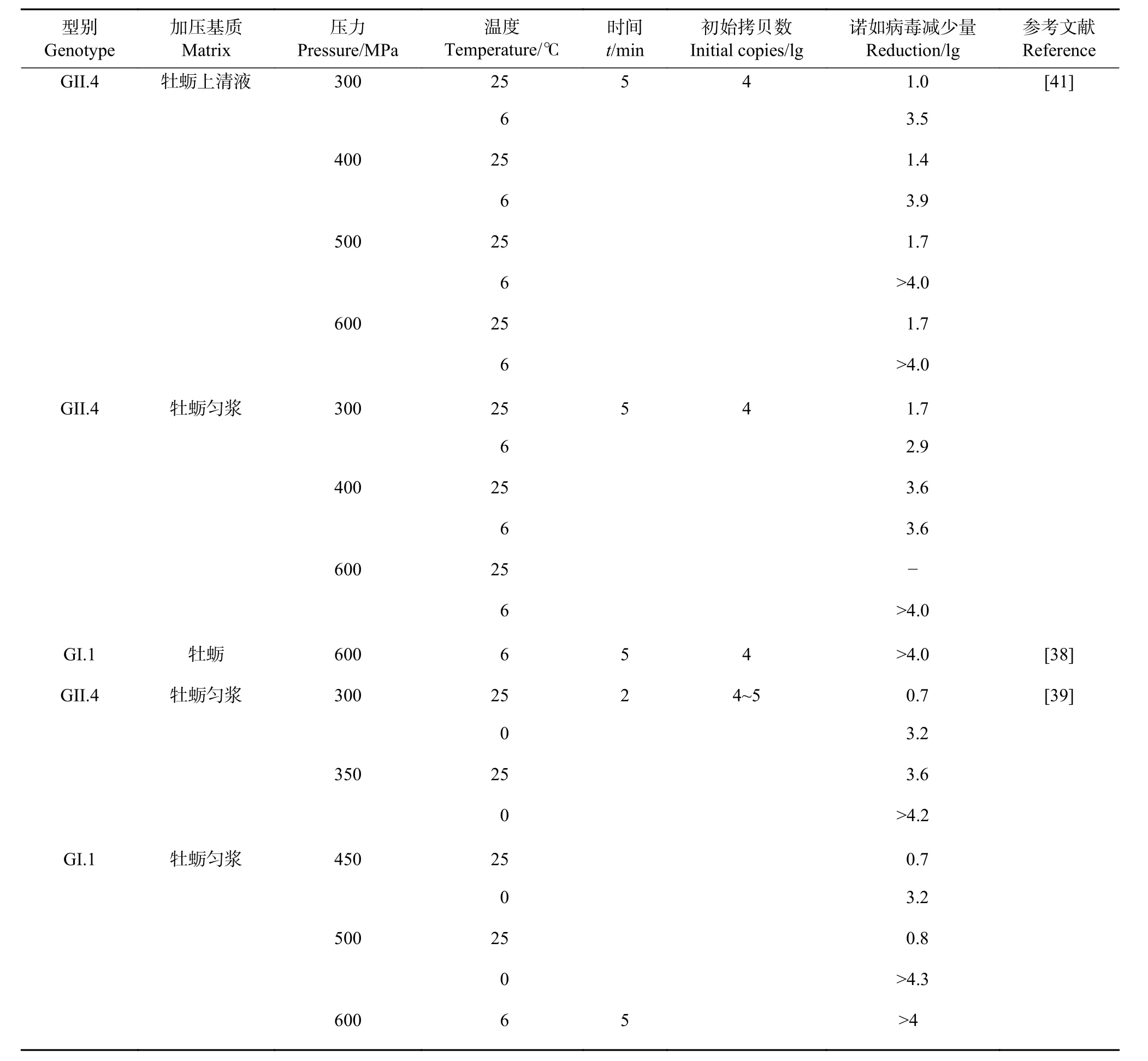
表2 超高压对牡蛎中诺如病毒消减效果的影响Table 2 Effects of high hydrostatic pressure on inactivation effect of NoV in oysters
此外,Kim等[63]将紫外线照射与HHP处理结合来灭活NoV的实验表明两者对病毒具有协同灭活作用。在实际生产中的成功应用证明,与单独的HHP处理相比,紫外照射辅助组合可实现更好的病毒灭活效果。
3.3.4 HHP在牡蛎产业应用中的挑战 HHP技术可以有效消减牡蛎体内的NoV,但它在牡蛎加工中的广泛应用仍面临诸多挑战。首先,最主要的挑战是设备成本较高,对小规模经营的牡蛎养殖场来说经济负担太大。其次,多个牡蛎养殖场联合共用一台HHP处理装置可降低成本,但也存在一些问题:若牡蛎养殖区分布广,会导致无法在短时间内及时加工牡蛎,这也是高品质牡蛎生产加工中所面临的问题;在牡蛎生产旺季时,又会因生产消费高峰而导致设备供不应求。最后,HHP技术生产的牡蛎产品,考虑其运作成本,将以高端牡蛎产品为主,且适合短期消费,现今在大众接受普及度方面相对较低。目前有关HHP对牡蛎中NoV消减效果的研究多以人工污染牡蛎匀浆为主,在评估消减效果方面的准确性不足,同时加压和卸压过程中可能发生变化和内在反应,这些还需更深入的研究。
4 展望
食源性NoV引发的公共安全事件越来越引起公众的关注。中国是世界上最大的牡蛎生产国,牡蛎是NoV传播的重要载体,其食用安全至关重要。研究牡蛎同NoV的结合特点与机制,建立可区分NoV感染性的检测方法,评价不同加工方式对NoV的消减效果,是提高牡蛎食用安全性的重要手段。在保持牡蛎的感官品质和营养物质的前提下,应用HHP处理等非热加工技术建立有效消减牡蛎中NoV的方法,开发新的牡蛎加工产品,是产业发展的迫切需要。
声明:本站未注明出处的转载文章是出于传递更多信息之目的。若有未注明出处或标注错误或侵犯了您的合法权益,请与本网站联系,我们将及时更正、删除,谢谢!


欢迎关注本站"养鱼第一线"微信公众帐号和头条号!将会定期向你推送本号信息!将为你精诚服务!






