通讯:13983250545
微信:ycsh638
QQ:469764481邮箱:ycsh6318@163.com
丁香酚对“优鲈3号”幼鱼运输水质及其血液、肌肉生理指标的影响

丁香酚对“优鲈3号”幼鱼运输水质及其血液、肌肉生理指标的影响
唐忠林 张佳佳 周国勤 陈树桥 徐钢春 徐跑 强俊 王佩佩
(1 南京市水产科学研究所,江苏南京 210036;2 中国水产科学研究院淡水渔业研究中心,江苏无锡 214000)
大口黑鲈“优鲈3号”(GS-01-001-2018)是2019年全国水产原种和良种审定委员会审定通过的新品种之一[1],是以“优鲈1号”(GS01-004-2010)和从美国引进的北方亚种为基础选育种群,经连续4代选育而获得的。相比“优鲈1号”和未选育群体,“优鲈3号”幼鱼和成鱼生长速度更快,一般养殖5~7个月即可达到上市规格,适合在我国淡水水域采用配合饲料进行养殖[2-3]。但目前我国鲈鱼养殖主要集中在广东、江苏、浙江和四川等地,呈现出分布不均(沿海多内地少、乡村多城市少)的局面,导致产区卖鱼难、销区吃鱼难,同种水产品在不同地区价格差异较大[4-5]。同时,鲜活鱼和冰鲜鱼的售价相差近1倍,鲜活鱼和冷冻鱼的价差甚至达几倍、十几倍,价格相差悬殊。因此,亟待研究安全有效的大口黑鲈活鱼运输技术。
麻醉运输是一种较为常见的中长途运输方式[6],而丁香油(主要成分为丁香酚)作为天然药物,被称为是最有效的麻醉剂。丁香酚具有溶解性高、麻醉效果好、价格低、使用安全、易于管控等优点[7],目前已被应用在鲻鱼(Mugilcephalus)[8]、暗纹东方鲀(Takifuguobscurus)[9]、日本黄姑鱼(Argyrosomusjaponicus)[10]等品种的生产运输上。
日本、澳大利亚、新西兰等国已明确规定丁香酚可作为合法的渔用麻醉剂[7],我国目前尚未出台相关的规章制度。日本规定丁香酚药浴剂量为50~200 μg/mL,休药期为7 d,最高残留量(MRL)为50 ng/mL[11]。联合国粮农组织和世界卫生组织食品添加剂联合专家委员会(JECFA)规定,丁香酚的每日允许摄入量(ADI)为0~2.5 mg/(kg·bw)[12]。考虑到丁香酚在使用的过程中会在鱼的肌肉和肝脏中富集,可能会带来食品安全等问题,已有学者进行了相关的研究。王鹏等[13]抽检了石斑鱼、鳜鱼和罗非鱼,所检样品中异丁香酚残留均小于6 mg/kg;王彩霞等[14]的研究结果也表明,经过48 h复苏后,加州鲈肝脏中的丁香酚可以完全代谢;经7 d暂养后,鱼肌肉中的丁香酚可完全代谢。总体上看,丁香酚类麻醉剂残留对人体健康未构成风险。
本研究以“优鲈3号”幼鱼为对象,开展静态麻醉和麻醉运输试验,探索丁香酚最优麻醉质量浓度,并检测麻醉运输过程中幼鱼血液和肌肉生理指标的变化,为丁香酚在“优鲈3号”幼鱼运输中的应用提供参考。
1 材料和方法
1.1 试验材料
试验用“优鲈3号”幼鱼[体质量(19.17±1.32) g,体长(11.14±0.26) cm]来自江苏南京帅丰饲料有限公司。试验鱼暂养在有生物过滤循环处理系统的恒温水族箱中,循环水流速为5 L/min,光照为14 h/d。暂养期间每天投喂2次(8:00—9:00和20:00—21:00)江苏南京帅丰饲料有限公司生产的大口黑鲈配合饲料。整个暂养和试验期间水体溶解氧高于5 mg/L,氨氮和亚硝酸盐质量浓度均低于0.01 mg/L。试验前24 h停止饲喂,试验期间不投饲。
丁香酚购自上海医疗器械有限公司。用乙醇作为溶剂制成10 g/L的母液,母液在使用当天制备,并保存于深色玻璃瓶中。
1.2 静水麻醉试验
麻醉试验在容量为10 L的水族箱中进行,试验水温为25 ℃。按丁香酚的质量浓度设置9个梯度组(3、6、9、12、15、18、21、24和27 mg/L),每个梯度组重复6尾鱼,每尾鱼单独观察并只使用1次,每重复3尾鱼更换新鲜溶液。参照Cooke等[15]以及王文豪等[16]的分类标准,结合“优鲈3号”幼鱼的实际情况,将麻醉诱导过程分为5个阶段,完全复苏标准为行为完全恢复(见表1)。最终得出适宜的静水麻醉剂质量浓度范围。再综合运输需求、存活率和残留代谢,选择合适的运输麻醉剂质量浓度。

表1 麻醉与复苏阶段“优鲈3号”幼鱼的行为特征
1.3 模拟麻醉运输试验
设置5种运输密度(30、50、70、90、110、130 g/L),每个密度组设3个平行,不添加麻醉剂模拟运输10 h,恢复24 h后统计存活率,得出适合 “优鲈3号”幼鱼的运输密度。
以上述合适的麻醉剂浓度和运输密度,模拟运输10 h,检测运输过程中和运输后的水质变化以及幼鱼血液和肌肉相关指标的变化。试验设置2个处理组:试验组(麻醉+运输)和对照组(无麻醉+运输),每组设3个重复。试验水温为25.0 ℃,用气石微充气,将整理箱固定于恒温振荡器中,以转速70 r/min模拟运输10 h。分别在运输0、2、4、6、8、10 h的时间点取样。
1.4 水质检测
试验结束后,立即采集运输水质于50 mL的聚乙烯离心管中,加盖密封。同时,用便携式氨氮测定仪测定水体的酸碱度(pH)和氨氮(NH4+-N)质量浓度。
1.5 血清指标测定
每个重复随机取3尾鱼,无抗凝剂尾静脉取血,合并为1个混合样,每个处理组共3个血液样本。全血样品在4 ℃下静置12 h,待血液分层后以3 000 r/min离心10 min,收集血清于2 mL离心管中。测定皮质醇、乳酸、尿素氮的含量和谷草转氨酶活性,所用试剂盒均购自南京建成生物工程研究所。
1.6 肌肉指标测定
每个重复随机取3尾鱼,取肌肉组织0.1 g,加入0.9 mL的生理盐水,冰水浴匀浆,以2 500 r/min离心10 min,取上清液测定蛋白质浓度和乳酸含量。称取5 g去骨去皮的鱼肉,加双蒸水匀浆2 min,定容至100 mL,转入离心管中,以5 000 r/min 离心10 min,过滤,取上清液测定pH。
1.7 数据统计与分析
试验所得数据均用(平均值±标准差)的方式表示,所有数据均用SPSS 25.0软件进行统计分析。利用单因素方差分析(one-way ANOVA)和Duncan’s多重比较检验法对同一试验组不同时间点以及不同试验组同一时间点的数据进行处理和检验分析,设显著性水平为0.05。用Origin 8.6软件绘图。
2 结果
2.1 丁香酚对“优鲈3号”幼鱼的静水麻醉及复苏效果
不同质量浓度丁香酚对“优鲈3号”幼鱼的麻醉及复苏效果见表2。由表2可知,质量浓度为3~27 mg/L的丁香酚均能使“优鲈3号”幼鱼进入镇静期,并且复苏率均为100%,质量浓度在21~27 mg/L,幼鱼进入A1(轻度镇静期)的时间无显著性差异(P>0.05);质量浓度6 mg/L的丁香酚能使“优鲈3号”幼鱼进入轻度麻醉期;质量浓度9~27 mg/L的丁香酚均能使其进入深度麻醉期,且随着丁香酚浓度的增加,“优鲈3号”幼鱼进入相同麻醉时期的时长缩短,同时完全复苏的时间也随之延长。复苏24 h内,丁香酚质量浓度为24 mg/L和27 mg/L的组“优鲈3号”幼鱼出现死亡,且死亡率随着麻醉剂浓度的增加而提高。综合考虑运输实际需求、成活率和残留代谢等因素,选择在“优鲈3号”幼鱼模拟运输试验中麻醉剂的质量浓度为6 mg/L。

表2 不同质量浓度丁香酚对“优鲈3号”幼鱼的麻醉及复苏效果
2.2 “优鲈3号”幼鱼在不同运输密度下的存活率
不同密度模拟运输后“优鲈3号”幼鱼的存活率情况见图1。试验鱼经10 h模拟运输后,30~90 g/L密度组的存活率和复苏后24 h成活率均为100%;当密度达到110 g/L时,试验鱼出现死亡现象,且恢复24 h期间也出现死亡,因此,选择90 g/L为“优鲈3号”幼鱼最适宜运输密度。

图1 不同密度运输后“优鲈3号”幼鱼的存活率
2.3 模拟麻醉运输中水质指标的变化
由图2-a可知,模拟麻醉运输开始时运输箱内水体pH约为7.5,前2 h内试验组水体pH的变化不显著(P>0.05)。随着运输时长的增加,试验组和对照组的pH均显著降低(P<0.05)。模拟运输试验过程中,试验组的pH一直高于对照组。运输10 h时对照组的pH最低约为6.6。
由图2-b可知,在模拟运输开始时水体中氨氮的质量浓度均低于0.1 mg/L。随着运输时长增加,对照组和试验组水体的氨氮质量浓度均显著上升(P<0.05),但与对照组相比,麻醉组相同运输时间的氨氮含量有明显降低 (P<0.05)。

注:不同字母表示同组不同运输时间点的数据有显著性差异(P<0.05);*表示与对照组同一时间点的数据有显著性差异(P<0.05),**表示差异极显著(P<0.01)。图2 “优鲈3号”幼鱼模拟麻醉运输时水质变化情况
2.4 模拟麻醉运输过程中血清指标变化
由图3-a可以看出,随着运输时长的增加,“优鲈3号”幼鱼血清中的皮质醇含量(COR)总体呈先上升再下降的趋势,其中对照组在运输6 h时达到峰值,随后下降,但在运输模拟结束时依旧显著高于运输开始时(P<0.05);麻醉组在运输2 h时即达到最高值,随后开始下降,但在运输模拟结束时依旧显著高于运输开始时(P<0.05)。在整个模拟运输的过程中,除运输4 h时两个组COR含量无显著差异外,其余时间点均存在显著差异(P<0.05)。其中,运输2 h时麻醉组高于对照组。
由图3-b可以看出,随着运输时间的延长,“优鲈3号”幼鱼血清中谷草转氨酶(AST)的活性总体呈上升趋势,模拟运输结束时对照组AST活性与运输起始相比提高了4.57倍,麻醉组则提高了3.88倍。在模拟运输的2—6 h,麻醉组AST活性显著高于对照组(P<0.05),模拟运输8—10 h,麻醉组AST活性低于对照组,但差异不显著(P>0.05)。
由图3-c可以看出,随着运输时间的延长,“优鲈3号”幼鱼血清中尿素氮(BUN)的含量有所增加,但是在运输的前6 h变化不是非常显著。模拟运输结束时对照组的BUN含量与运输起始相比增加了0.74倍,麻醉组增加了0.37倍。在整个模拟运输试验过程中麻醉组BUN含量均低于对照组,且在运输的8—10 h显著低于对照组(P<0.05)。
由图3-d可以看出,随着运输时间的延长,“优鲈3号”幼鱼血清中的乳酸(LD)含量显著增加(P<0.05)。在模拟运输2 h时,对照组LD含量没有明显变化(P>0.05),而麻醉组LD含量显著增加了(P<0.05)。模拟运输试验结束时对照组LD含量与运输起始相比增加了3.27倍,麻醉组增加了2.48倍。在整个模拟运输试验过程中,麻醉组的LD含量均低于对照组,且在运输的6—10 h显著低于对照组(P<0.05)。
2.5 模拟麻醉运输过程中肌肉指标变化
“优鲈3号”幼鱼在麻醉模拟运输中肌肉指标的变化见图4。可以看出,“优鲈3号”幼鱼在运输过程中肌肉乳酸、pH均发生了一定程度的变化,二者呈负相关关系。其中对照组乳酸的含量随着运输时间的延长显著升高(P<0.05),在运输10 h时达到1.95 mmol/(g·prot),为运输起始时的3.09倍;麻醉组在运输4 h时显著升高(P<0.05),直至运输10 h时肌肉乳酸的含量达到1.36 mmol/(g·prot),相对初始时升高了1.15倍。模拟运输过程中麻醉组乳酸的积累量均显著低于对照组(P<0.05)。肌肉pH的变化与乳酸相反,总体呈下降趋势,且变化显著(P<0.05)。对照组由最初的7.02下降至6.59,降低了6.21%。麻醉试验组由起始的7.02下降至6.73,降低了4.19%。运输的过程中麻醉组pH均显著高于对照组(P<0.05)。
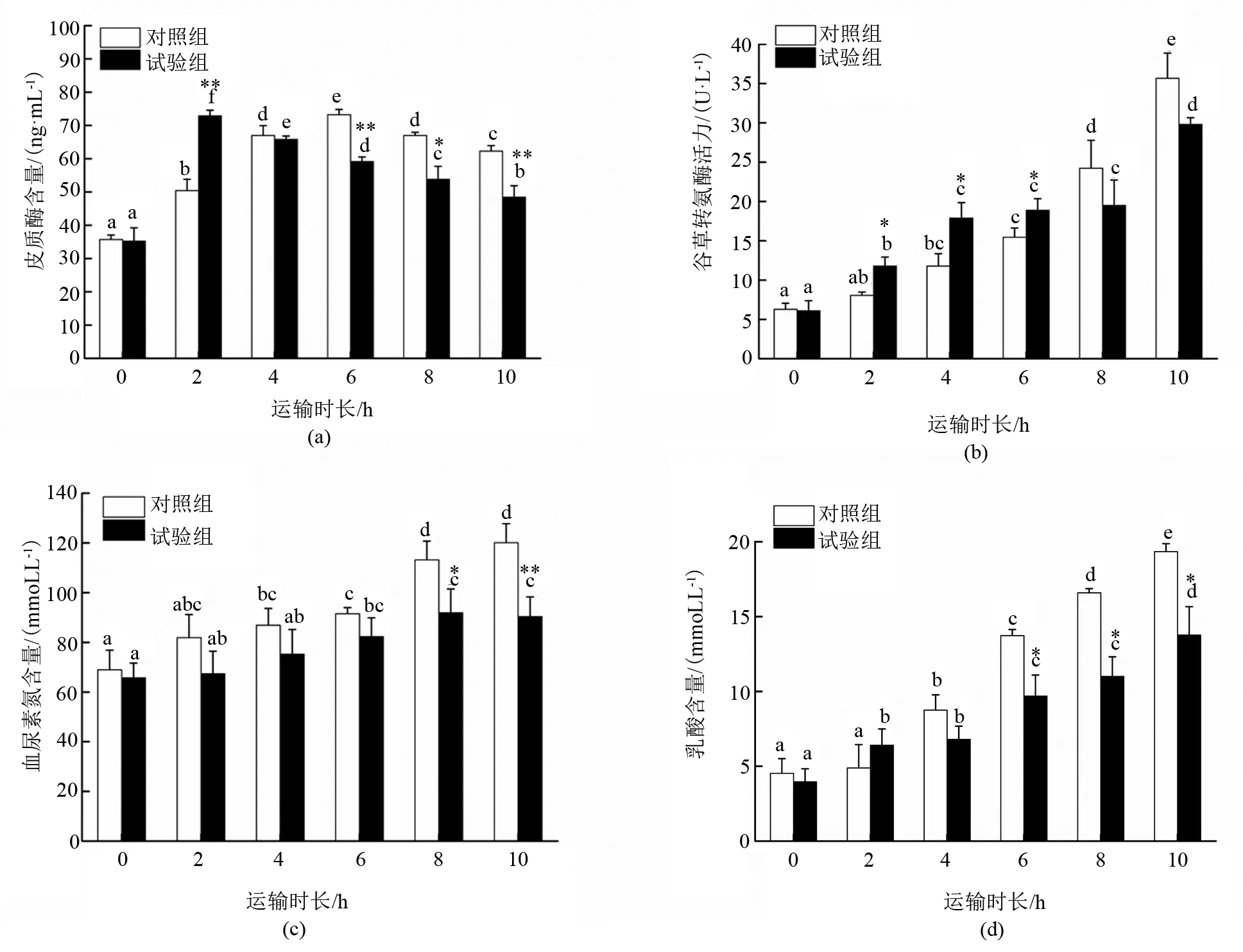
注:不同字母表示同组不同运输时间点的数据有显著性差异(P<0.05);*表示与对照组同一时间点的数据有显著性差异(P<0.05),**表示差异极显著(P<0.01)。图3 “优鲈3号”幼鱼在麻醉模拟运输中血液指标的变化
3 讨论
3.1 丁香酚对“优鲈3号”幼鱼的麻醉效果
丁香酚作为天然的麻醉剂,自1972年被发现对鱼类有麻醉作用后,国内外学者已对多种鱼类进行了麻醉试验,如革胡子鲶(Clariasgariepinus)[17]、斑点叉尾鱼回(IetalurusPunetaus)[18]等,均获得了较好的麻醉效果。从本试验结果看,丁香酚能快速达到麻醉和复苏效果,具有较高的时效性。但是麻醉剂量的选择也是麻醉运输中重要的一环,麻醉剂浓度过高可能会使鱼体出现窒息死亡,降低成活率,例如质量浓度66 mg/L的丁香酚使得大西洋鲑死亡率高达90%[19];而麻醉剂浓度过低则不能使鱼在运输过程中处于镇静状态。本试验中,当丁香酚质量浓度在6~27 mg/L时,“优鲈3号”幼鱼均能进入深度镇静和麻醉期。但当丁香酚的浓度高于24 mg/L时,幼鱼出现死亡。原因可能是丁香酚麻醉浓度过高,过量的丁香酚聚积在鱼的肝脏,使得鱼类死亡[20],也可能是过度麻醉降低了鱼体的呼吸频率,导致其动脉中氧分压降低,呼吸不畅,加上血氧降低、二氧化碳升高,因而鱼的血压和心率发生变化[21]。另外,王文豪等[16]发现,16 mg/L的丁香酚能引起体质量为130 g的大口黑鲈死亡,这一结果与本试验结果稍有差异,原因可能是相较于普通大口黑鲈,“优鲈3号”幼鱼对丁香酚的耐受性有所增强,同时也可能与鱼体大小、温度等因素有关[14]。相似的结果也在对白鱼(Coregonuslavaretus)[22]和大西洋鲑[18]的麻醉试验中发现。Marking等[23]认为,理想的麻醉剂浓度是3 min内能够使鱼麻醉,5 min内能够令其苏醒。按照此标准,12~18 mg/L的丁香酚麻醉液是“优鲈3号”幼鱼静水麻醉的理想麻醉剂浓度。但是,在实际运输生产中还应该综合考虑运输时间、成活率、残留代谢等因素,因此,在模拟麻醉运输试验时选取的麻醉剂质量浓度为6 mg/L。

图4 “优鲈3号”幼鱼麻醉模拟运输中肌肉指标的变化
3.2 运输密度
高密度运输可以有效降低运输的成本,但是密度过高会使鱼苗相互挤压,从而导致鱼受伤甚至死亡。同时高密度运输会引起水体中氨氮、溶解氧和pH的显著变化,不良的水质也会使鱼受到伤害,或在运输后出现免疫力降低,发生病害甚至死亡,这都不利于养殖生产[24-25]。陈旭等[26]研究发现,随着尖吻鲈(Latescalcarifer)运输密度的提高,运输水体中氨氮、亚硝酸盐浓度显著升高,溶解氧和pH显著降低。张伟等[27]对大黄鱼(Larimichthyscrocea)的运输试验也得出了类似的结论,同时发现,随着运输密度的增加,幼鱼的死亡率也显著升高,当运输密度为8 g/L时,鱼的死亡率接近50%。由此可以看出,选择合适的运输密度在实际生产运输中尤为关键。本试验发现,当“优鲈3号”幼鱼的密度高于110 g/L时,幼鱼出现死亡,且恢复24 h后仍然出现死亡;王文豪等[16]以130 g/L的密度进行大口黑鲈运输,运输后鱼的死亡率为80%,恢复24 h死亡率为60%。综上,本试验选取“优鲈3号”幼鱼的模拟运输密度为90 g/L。
3.3 麻醉运输对水质的影响
水体是鱼类进行气体交换和离子交换的主要媒介,同时也是代谢鱼体废物的净化剂。但在鱼类的运输中,由于运输时长、容器、运输密度等客观因素的影响,运输水体的水质会剧烈变化,从而影响运输效率和成活率[28-29]。本试验以90 g/L的运输密度,在25 ℃的运输温度下,随着运输时间的延长,运输水体逐渐变得混浊,氨氮含量显著升高,pH显著降低。相似的结果也在翘嘴鲌(Culteralburnus)[29]、倒刺鲃(Spinibarbusdenticulatus)[30]等运输中发现。原因可能是运输震动、挤压等胁迫使得鱼类代谢速率加快,继而耗氧率增加,CO2和氨氮等代谢废物的排泄量也增加。而CO2溶于水中又会导致水体pH降低[26],当pH偏低时,水体中亚硝酸盐、硫化氢的毒性增强。同时,CO2在血浆中富集会导致血浆酸化,降低血液的携氧能力和血红蛋白对氧气的亲和力[31]。另一方面,当水体中氨氮含量过高时,还会抑制鱼体向外排氨,从而导致鱼体血液中氨氮含量显著升高,血液的载氧能力降低,使鱼体缺氧而死[32]。本试验也发现添加丁香酚的麻醉组水体中氨氮含量显著低于对照组,pH显著高于对照组,原因可能是丁香酚使幼鱼处于镇静状态。在这种状态下,幼鱼活动量减少,相互之间的摩擦挤压会减少,同时呼吸频率有所减弱,CO2和氨氮等代谢废物的排泄速率也会随之减弱。值得一提的是,王利娟[33]在用丁香油麻醉运输大口黑鲈的试验中发现,随着运输时间的增加,因而水体pH不断升高,这与本试验的结果不一致。原因可能是水体中氨氮的含量还没有达到抑制鱼体氨氮排放的浓度,鱼体仍然可以持续排氨,因而水体pH持续升高;也可能是运输时长的原因。有研究表明,随着运输时间的增加,鱼体氨的排泄速率会明显上升[23]。
3.4 麻醉运输对幼鱼血液指标的影响
运输过程中的长时间持续震荡摇晃,会造成鱼类机体较大程度的应激和其他继发损伤,这些首先会表现在生理指标的变化上。皮质醇(COR)、尿素氮(BUN)、谷草转氨酶(AST)和乳酸(LD)是最直接的指标,被广泛用于评价鱼体健康状况及对环境的适应情况[24,34]。
皮质醇(COR)是肾上腺在应激反应中产生的类激素,作为激素反应链的最后一项激素,其变化可以作为生物体应激状态的重要指标[23]。大量的研究表明,在温度、盐度及运输挤压等各种胁迫应激下,都会引起COR的升高,且COR随着应激强度的增加而上升[35-36]。例如,褐牙鲆在盐度为3的条件下胁迫1 d后,其血浆COR显著升高[35];以8 g/L的密度运输大黄鱼幼鱼,运输后COR的含量为运输前的4倍多[27];以质量浓度5 mg/L的丁香酚麻醉卵形鲳鲹鱼苗,鱼苗的血清COR显著升高[37]。本试验中,麻醉组和对照组的COR含量均显著升高,这说明在运输过程中鱼体因为震动摇晃产生了应激。值得关注的是,麻醉组COR达到峰值的时间要早于对照组,原因可能是丁香酚对鱼体有一定的刺激作用,但是随着运输时间的延长,COR均有所下降,可能是鱼体适应了麻醉剂的刺激,同时麻醉剂降低了鱼体对外界的应激。
谷草转氨酶(AST)主要存在于肝脏组织中,是肝脏中连接糖、脂质和蛋白质代谢的重要酶。正常情况下,机体血清中AST活性较低且相对稳定,但当组织器官受损时,AST就会大量释放到血液中,使血清AST活性增强,因此AST可以作为肝脏受损的指标[34,38]。本试验结果表明,在开始运输的2—6 h,麻醉组的AST活性显著高于对照组,这与王文豪等[16]采用50 mg/L MS-222和10 mg/L丁香酚麻醉运输大口黑鲈幼鱼的结果类似,推测可能是丁香酚会引起肝脏方面的问题[20]。本试验运输结束时,对照组和麻醉组的AST活性均显著升高,相似的结果也在斑点叉尾鱼回[39]、鲫鱼[40]的保活运输中发现。原因可能是麻醉剂对幼鱼的肝脏产生了影响,幼鱼为了应对丁香酚麻醉的胁迫,体内合成释放更多的酶,从而导致AST活性升高,也可能是运输水体中氨氮浓度升高,对鱼的肝脏结构损伤较大。
尿素氮(BUN)是反映肾功能代谢的重要指标[14]。本试验中,运输前期对照组和麻醉组BUN含量的变化并不显著,这与大口黑鲈[14,33]的运输结果相似,表明在短途运输时,鱼体会自我调节,应对运输过程的各种胁迫。但是随着运输时间的延长,BUN的含量显著升高。原因可能是鱼体新陈代谢使得水体中氨氮浓度过高,从而抑制了鱼类排氨,导致鱼体内BUN升高;也可能是长时间的震动刺激导致鱼体的蛋白质代谢异常,其肾功能出现障碍或受损部分[33]。
乳酸(LD)是鱼体肌肉无氧代谢产物,对机体有一定危害。在本试验中,运输开始2 h时对照组LD含量无明显变化,而麻醉组的LD含量显著增加(P<0.05),原因可能是丁香酚对其产生了一定的刺激[41],导致鱼体血浆乳酸浓度升高。运输结束时对照组和麻醉组血清和肌肉中的LD含量都显著升高,但麻醉组的LD含量低于对照组,可能是震动等因素导致鱼体肌肉无氧代谢显著增加。如银鲳[42]在经过12 h运输后,其血清和肌肉中的乳酸含量在运输胁迫后均显著升高。
3.5 麻醉运输对幼鱼肌肉指标的影响
大量的研究表明,不论是无水保活运输还是有水保活运输均会导致鱼类肌肉pH降低[34,43]。本试验结果也显示,对照组和麻醉组肌肉的pH均随着运输时间的延长而降低,乳酸含量则增加了,这与王彩霞等[14]、王利娟[33]对大口黑鲈的研究结果一致。引起肌肉pH下降的主要原因是无氧代谢增加,肌肉组织中的糖原发生无氧酵解而生成大量乳酸,同时水体中氨氮胁迫也使肌肉pH下降。随着pH下降,鱼体就会出现肌肉硬度降低、肉质松散等问题。但是王彩霞等[14]发现,经过一段时间的暂养,鱼体肌肉可恢复到正常水平,原因可能是鱼体内的乳酸被乳酸脱氢酶催化转化代谢掉了。也有研究认为,在低温条件下进行运输,鱼体呼吸强度降低,不会积累大量乳酸而引起pH快速下降[34]。因此,在活鱼运输中要尽可能降低运输温度。同时在运输结束后可暂养几天,待鱼体恢复后再上市,这样可以保证鱼肉的品质,同时也使丁香酚的残留物尽可能代谢掉,保障食品安全。
4 结论
在本试验中,随着丁香酚质量浓度的升高,幼鱼进入麻醉期的时间缩短,复苏时间延长,12~18 mg/L的丁香酚是“优鲈3号”幼鱼理想的静水麻醉液。但综合考虑运输需求、鱼的存活率和残留代谢等因素,模拟麻醉运输中采用的丁香酚麻醉液的质量浓度以6 mg/L为宜。在90 g/L的运输密度下模拟麻醉运输10 h,运输水质会恶化,也会使鱼体产生一定的应激反应,血液中皮质醇(COR)、尿素氮(BUN)和乳酸(LD)含量以及谷草转氨酶(AST)活性升高,肌肉中pH降低,乳酸(LD)升高。但是使用丁香酚麻醉液可以使相关指标的变化程度减弱,有利于减轻“优鲈3号”的应激反应。
声明:本站未注明出处的转载文章是出于传递更多信息之目的。若有未注明出处或标注错误或侵犯了您的合法权益,请与本网站联系,我们将及时更正、删除,谢谢!
欢迎关注本站(可搜索)"养鱼第一线"微信公众号和微信视频号"养鱼第一线刘文俊视频号"!以及头条号"水花鱼@渔人刘文俊",将会定期向你推送信息!






